题目内容
设NA为阿伏加德罗常数的值,下列叙述正确的( )
| A、50mL 12 mol?L-1浓盐酸与足量二氧化锰加热反应,转移电子数为0.3 NA |
| B、5.6 g铁与0.1 mol氯气充分反应转移电子数为0.3NA |
| C、1L1mol?L-1NaClO溶液中含有ClO-的数目为NA |
| D、60gSiO2晶体中含有硅氧键的数目为4 NA |
考点:阿伏加德罗常数
专题:
分析:A、浓盐酸分别稀盐酸,反应会停止,生成的氯气小于0.15mol;
B、5.6g铁物质的量是0.1mol,反应消耗0.15mol氯气,显然氯气不足;
C、次氯酸根离子部分水解,导致溶液中次氯酸根离子数目减少;
D、1molSiO2晶体含有4mol的硅氧键.
B、5.6g铁物质的量是0.1mol,反应消耗0.15mol氯气,显然氯气不足;
C、次氯酸根离子部分水解,导致溶液中次氯酸根离子数目减少;
D、1molSiO2晶体含有4mol的硅氧键.
解答:
解:A、浓盐酸的物质的量是0.6mol,完全反应生成氯气0.15mol,由于浓盐酸变成稀盐酸,变化继续反应,故生成的氯气小于0.15mol,转移电子数小于0.3 NA,故A错误;
B、铁的物质的量是0.1mol,完全反应消耗0.15mol氯气,氯气不足,反应按照氯气的量进行,反应转移电子数为 0.2NA,故B错误;
C、1L1mol?L-1的NaClO溶液中含有溶质次氯酸钠1mol,由于次氯酸根离子部分水解,溶液中次氯酸根离子小于1mol,含有ClO-的数目小于NA,故C错误;
D、1molSiO2晶体含有4mol的硅氧键,60g SiO2晶体就是1mol,含有硅氧键的数目为4 NA,故D正确.
故选D.
B、铁的物质的量是0.1mol,完全反应消耗0.15mol氯气,氯气不足,反应按照氯气的量进行,反应转移电子数为 0.2NA,故B错误;
C、1L1mol?L-1的NaClO溶液中含有溶质次氯酸钠1mol,由于次氯酸根离子部分水解,溶液中次氯酸根离子小于1mol,含有ClO-的数目小于NA,故C错误;
D、1molSiO2晶体含有4mol的硅氧键,60g SiO2晶体就是1mol,含有硅氧键的数目为4 NA,故D正确.
故选D.
点评:本题考查阿伏伽德罗常数,注意浓盐酸制取氯气的反应,浓盐酸不会完全反应,本题难度中等.

练习册系列答案
相关题目
可逆反应:2A(g)+B(g)?3C(g)+D(g).试根据如图判断正确的是( )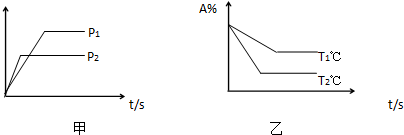

| A、温度T1℃比 T2℃高 |
| B、正反应为放热反应 |
| C、甲图纵轴可以表示A的转化率 |
| D、甲图纵轴可以表示混合气体平均相对分子质量 |
某氧化物的化学式为R2O3,电子总数为50,已知氧原子核内有8个中子,R2O3的相对分子质量为102,则R原子核内中子数为( )
| A、10 | B、12 | C、14 | D、21 |
下列物质中,易溶于水的是( )
| A、KNO3 |
| B、BaSO4 |
| C、AgCl |
| D、CuO |
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、物质的量浓度为1 mol/L的K2SO4溶液中,含2 NA个K+ |
| B、把40 g NaOH固体溶于1 L水中,所得溶液中NaOH的物质的量浓度为1 mol?L-1 |
| C、常温常压下,71 g Cl2含有2 NA个Cl原子 |
| D、标准状况下,11.2 L 氦气中含有的原子数为NA |
下列叙述正确的是( )
| A、一定温度、压强下,固体的体积只由其分子的大小决定 |
| B、一定温度、压强下,气体体积由其物质的量的多少决定 |
| C、等物质的量浓度的盐酸和硫酸中,H+的物质的量浓度相等 |
| D、气体摩尔体积是指1mol任何气体所占的体积为22.4L |
一定有化学变化发生的过程是( )
| A、蒸馏 | B、升华 | C、燃烧 | D、蒸发 |
 ,
,