题目内容
6.金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示.下列叙述不正确的是( )
| A. | 石墨燃烧热为-393.5kJ/mol | |
| B. | CO2和金刚石(或石墨)反应生成CO为吸热反应 | |
| C. | 等量金刚石和石墨完全燃烧,石墨放出的热量更多 | |
| D. | 12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为252.0kJ |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,依据图象的反应能量变化计算焓变,结合热化学方程式写出;
B.CO2和金刚石(或石墨)反应生成CO的反应,可以依据图象书写热化学方程式计算分析判断;
C.依据物质能量越高,越活泼分析判断,依据图象能量变化写出石墨转化为金刚石的热化学方程式,反应是吸热反应;
D.依据极值计算判断生成的气体组成,结合热化学方程式计算得到.
解答 解:A.石墨燃烧生成二氧化碳放热110.5KJ+283.0KJ=393.5KJ;反应的热化学方程式为:C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 ,石墨燃烧热为-393.5kJ/mol,故A正确;
B.依据图象分析,①C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 ;②C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ•mol-1
②×2-①得到CO2(g)+C(石墨,s)=2CO(g)△H=172.9KJ/mol,反应吸热,故B正确;
C.图象分析金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,图象分析石墨转化为金刚石需要吸收热量=395.4KJ-393.5KJ=1.9KJ;反应的热化学方程式为C(石墨,s)═C(金刚石,s)△H=+1.9 kJ•mol-1,依据图象分析可知,金刚石能量高于石墨,等量金刚石和石墨完全燃烧,金刚石放出能量高,故C错误;
D.12g石墨物质的量为1mol,在一定量空气中燃烧,依据元素守恒,若生成二氧化碳质量为44g,若生成一氧化碳质量为28g,生成气体36g,28g<36g<44g,判断生成的气体为一氧化碳和二氧化碳气体,设一氧化碳物质的量为x,二氧化碳物质的量为(1-x)mol,28x+44(1-x)=36g,x=0.5mol,二氧化碳物质的量为0.5mol;依据图象分析,C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 ;C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ•mol-1
生成二氧化碳和一氧化碳混合气体放出热量=393.5 kJ•mol-1 ×0.5mol+110.5 kJ•mol-1 ×0.5mol=252KJ;12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为252.0kJ,故D正确.
故选C.
点评 本题考查了化学反应能量变化的图象分析计算,热化学方程式的书写方法,掌握基础是关键,题目难度中等.

| A. | 4mol | B. | 3.4mol | C. | 2.8mol | D. | 1.2mol |
| A. | 能够使甲基橙呈现黄色 | B. | 溶液的pH>7 | ||
| C. | 溶液中:c(H+)>1×10-7mol•L-1 | D. | 溶液中:c(H+)<c(OH-) |
| A. | 1mol碳正离子CH5+所含的电子数为11NA | |
| B. | 标准状况下,22.4L辛烷完全燃烧后生成二氧化碳分子数为8NA | |
| C. | 0.5mol乙烷分子中含共价键3.5NA | |
| D. | 乙烷可以发生氧化反应和取代反应.30g乙烷完全燃烧消耗3.5mol氧气,与氯气反应生成C2H4Cl2时,一定为纯净物 |
 的叙述正确的是( )
的叙述正确的是( )| A. | 有两种结构 | B. | 只有一种结构 | C. | 含有非极性键 | D. | 有四种结构 |
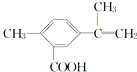
| A. | 该有机物的分子式为C11H12O2 | |
| B. | 1 mol该物质最多能与4 mol H2发生加成反应 | |
| C. | 该有机物能与热的新制氢氧化铜悬浊液反应,生成砖红色沉淀 | |
| D. | 该有机物在一定条件下,可以发生取代、氧化、酯化反应 |
| A. | 元素的电负性呈周期性变化 | |
| B. | 元素的第一电离能呈周期性变化 | |
| C. | 元素原子的核外电子排布呈周期性变化 | |
| D. | 元素的金属性、非金属性呈周期性变化 |
| A. | 弱电解质的电离是一个吸热的过程 | |
| B. | 化学反应中的能量变化不仅仅表现为热量变化 | |
| C. | 反应物的总能量大于生成物的总能量的反应是吸热反应 | |
| D. | 断裂化学键吸收能量,形成化学键放出能量 |
 .
. .X在纯氧中燃烧的产物无毒无污染,该反应的化学方程式为4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
.X在纯氧中燃烧的产物无毒无污染,该反应的化学方程式为4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O. .
.