题目内容
15.元素性质呈周期性变化的根本原因是( )| A. | 元素的电负性呈周期性变化 | |
| B. | 元素的第一电离能呈周期性变化 | |
| C. | 元素原子的核外电子排布呈周期性变化 | |
| D. | 元素的金属性、非金属性呈周期性变化 |
分析 根据元素周期律可知,元素的性质随原子序数的递增而呈现周期性的变化,而这种变化是由原子的电子排布的周期性变化引起的来解答.
解答 解:A.元素的电负性为元素的性质,不能解释元素性质的周期性变化,故A错误;
B.元素的第一电离能属于元素的性质,不能解释元素性质的周期性变化,故B错误;
C.由原子的电子排布可知,随原子序数的递增,原子结构中电子层数和最外层电子数呈现周期性变化,则元素原子的核外电子排布的周期性变化是元素的性质呈周期性变化的根本原因,故C正确;
D.因元素的金属性和非金属性都是元素的性质,则不能解释元素性质的周期性变化,故D错误;
故选C.
点评 本题考查元素周期律的实质,为高频考点,把握结构决定性质及周期律的周期性理解为解答的关键,侧重分析与应用能力的考查,注意常见的元素性质,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
6.金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示.下列叙述不正确的是( )


| A. | 石墨燃烧热为-393.5kJ/mol | |
| B. | CO2和金刚石(或石墨)反应生成CO为吸热反应 | |
| C. | 等量金刚石和石墨完全燃烧,石墨放出的热量更多 | |
| D. | 12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为252.0kJ |
3.下列有关银镜反应实验的说法正确的是( )
| A. | 向2%的稀氨水中滴入2%的硝酸银溶液至沉淀恰好溶解,配得银氨溶液 | |
| B. | 实验前试管先用热的烧碱溶液洗涤,再用蒸馏水洗涤 | |
| C. | 醛类一定能发生银镜反应,能发生银镜反应的一定是醛类 | |
| D. | 可用浓盐酸洗去银镜 |
20.取5.8g某种饱和一元醛与足量的银氨溶液混合,加热充分反应后析出21.6g金属银,则该醛为( )
| A. | 甲醛 | B. | 乙醛 | C. | 丙醛 | D. | 丁醛 |
7.下列离子方程式书写不正确的是( )
| A. | Fe与稀盐酸反应:Fe+2H+═Fe3++H2↑ | |
| B. | 盐酸与NaOH溶液反应:H++OH-═H2O | |
| C. | CaCO3与稀HNO3反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | BaCl2溶液与Na2SO4溶液反应:Ba2++SO42-═BaSO4↓ |
4.如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
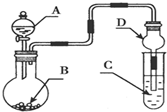

| A. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 | |
| B. | 若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色 | |
| C. | 若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊 | |
| D. | 若A为浓H2SO4,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色 |
5.在一定温度下,体积不变的密闭容器中,可逆反应X(g)+3Y(g)?2Z(g)达到平衡的标志是( )
| A. | 气体总质量保持不变 | B. | 气体密度保持不变 | ||
| C. | X、Y、Z的物质的量不再发生变化 | D. | X、Y、Z的分子数之比为1:3:2 |