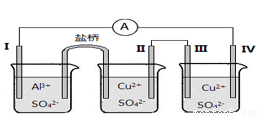
题目内容
15.NA代表阿伏加德常数,下列说法中,正确的是( )| A. | 在同温同压时,相同体积的任何气体单质所含的原子数目相同 | |
| B. | 2 g氢气所含原子数目为NA | |
| C. | 在常温常压下,11.2 L氮气所含的原子数目为NA | |
| D. | 17 g氨气所含原子数目为4 NA |
分析 A、气体单质分为单原子分子、双原子分子和多原子分子;
B、氢气由氢原子构成;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、求出氨气的物质的量,然后根据氨气中含4个原子来分析.
解答 解:A、气体单质分为单原子分子、双原子分子和多原子分子,故同温同压下,相同体积的任何气体单质的物质的量相同,但含有的原子个数不一定相同,故A错误;
B、氢气由氢原子构成,故2g氢气中含有的氢原子的物质的量为2mol,个数为2NA个,故B错误;
C、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氮气的物质的量小于0.5mol,则含有的氮原子小于NA个,故C错误;
D、17g氨气的物质的量为1mol,而氨气中含4个原子,故1mol氨气中含4NA个原子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
8.下列反应中,属于氧化还原反应的是( )
| A. | Na2CO3+CaCl2═CaCO3↓+2NaCl | B. | Fe+CuSO4═Cu+FeSO4 | ||
| C. | CaO+H2O═Ca(OH)2 | D. | NaOH+HCl═NaCl+H2O |
3.下列示意图与对应的反应情况符合的是( )
| A. | 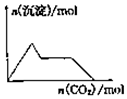 向含0.01mol KOH和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2至过量 | |
| B. | 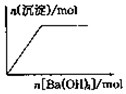 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量 | |
| C. | 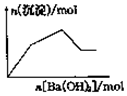 向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量 | |
| D. | 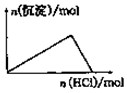 向NaAlO2溶液中逐滴加入盐酸至过量 |
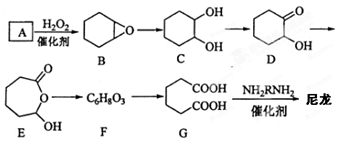
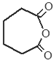 .
. .
.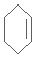 $\stackrel{Br_{2}/CCl_{4}}{→}$
$\stackrel{Br_{2}/CCl_{4}}{→}$ $→_{△}^{NaOH/C_{2}H_{5}OH}$
$→_{△}^{NaOH/C_{2}H_{5}OH}$ .
.
 H++In-(黄色),对上述平衡解释不正确的是
H++In-(黄色),对上述平衡解释不正确的是