题目内容
已知钋的原子序数是84,是一种放射性元素,被称为世界上最毒的物质.钋在元素周期表中的位置是( )
| A、第七周期第ⅥA族 |
| B、第六周期第ⅥA族 |
| C、第六周期第ⅡA族 |
| D、第五周期第ⅥA族 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:主族元素中,原子核外电子层数与其周期数相等,原子核外最外层电子数与其主族族序数相等,该元素原子结构示意图为 ,据此分析解答.
,据此分析解答.
 ,据此分析解答.
,据此分析解答.解答:
解:主族元素中,原子核外电子层数与其周期数相等,原子核外最外层电子数与其主族族序数相等,该元素原子结构示意图为 ,根据其原子结构示意图知,该元素位于第六周期第VIA族,故选B.
,根据其原子结构示意图知,该元素位于第六周期第VIA族,故选B.
 ,根据其原子结构示意图知,该元素位于第六周期第VIA族,故选B.
,根据其原子结构示意图知,该元素位于第六周期第VIA族,故选B.
点评:本题考查了元素在周期表中位置的判断,明确元素原子核外电子层数与周期数、最外层电子数与主族族序数之间的关系是解本题关键,根据其原子结构示意图来确定元素的位置即可,原子核外电子排布规律为学习难点,题目难度中等.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
X元素的阳离子与Y的阴离子具有相同的核外电子排布,则下列比较中正确的是( )
| A、原子序数:X<Y |
| B、原子半径:X<Y |
| C、离子半径:X>Y |
| D、最外层电子数:X<Y |
已知在比较酸的强弱时,必须考虑两方面:一是电离出氢离子的能力,二是溶剂接受氢离子的能力.比如HCl在水中是强酸,在冰醋酸中就是弱酸;而HAc在水中是弱酸,在液氨中却是强酸,就是因为接受氢离子的能力:NH3>H2O>HAc.下列关于酸性强弱的说法正确的是( )
| A、在A溶剂中,甲的酸性大于乙;在B的溶剂中,甲的酸性可能小于乙 |
| B、比较HCl、H2SO4、HClO4、HNO3酸性的强弱,用水肯定不可以,用冰醋酸可能可以 |
| C、HNO3在HClO4中是酸,在H2SO4中可能是碱 |
| D、比较HCN与HAc酸性的强弱,用水肯定可以,用液氨肯定也可以 |
下列有机物命名正确的是( )
A、 ,2-乙基丙烷 ,2-乙基丙烷 |
| B、(CH3)2CH-异丙基 |
C、 间二甲苯 间二甲苯 |
D、 2-甲基-2-丙烯 2-甲基-2-丙烯 |
25℃时,某溶液中含有Na+、H+、Fe3+、HC03-、OH-、I-中的几种离子,已知由水电离出的c(H+)=1×10-13 mol?L-1.向该溶液中缓慢通人一定量的Cl2后,溶液由无色变为黄色.下列关于该溶液的分析,错误的是( )
| A、pH=l或pH=13 |
| B、阴离子肯定有I-,不能确定有无HCO3 |
| C、阴离子肯定没有Fe3+,不能确定有无Na+ |
| D、溶质有3种可能:①HI②HI和NaI③NaI和NaOH |
某可逆反应过程的能量变化如图所示,下列说法正确的是( )


| A、该反应过程为吸热反应 |
| B、若加入催化剂,B点会降低 |
| C、若加入催化剂,△H数值会减小 |
| D、若升高温度,则平衡向正反应方向移动 |
下列各组微粒中,互为同位素的是( )
| A、金刚石和石墨 | ||||
B、
| ||||
| C、D2O和H2O | ||||
D、
|
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).能判断该反应是否达到化学平衡状态的依据是( )
| A、容器中压强不变 |
| B、单位时间内消耗了n mol CO2,同时生成了n mol H2O |
| C、v正(H2)=v逆(H2O) |
| D、c(CO2)=c(CO) |

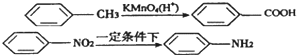
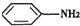 (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化)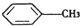 与浓硫酸、浓硝酸混合在不同温度下会得到不同产物.
与浓硫酸、浓硝酸混合在不同温度下会得到不同产物.