题目内容
3.E是一种重要的高分子酯,其合成线路如图所示,其中A是苯的同系物,1molA与1mol苯分别完全燃烧时,A比苯多消耗3molO2,A的核磁共振氢谱有3组峰;B与X互为同分异构体;1molC发生银镜反应时最多可得到4molAg.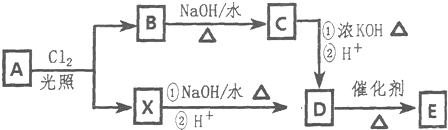
已知:
(1)
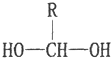 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$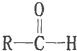
(2)2-CHO$→_{②H+}^{①浓KOH△}$CH2OH+COOH
(1)A的名称是邻二甲苯或1,2-二甲苯.
(2)X的结构简式为

(3)C发生银镜反应的离子反应方程式
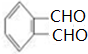 +4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$
+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$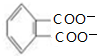 +2NH4++4Ag+6NH3+2H2O
+2NH4++4Ag+6NH3+2H2O(4)D→E的化学方程式为
 .
.(5)同时满足下列条件的D的同分异构体(不考虑立体异构)的有19种,
①能与浓溴水发生取代反应;②能发生水解反应.
其中核磁共振氢谱有5组峰的结构简式为
 .
.(6)以C和乙烯为基本原料,经如图所示变化可得到一种用途广泛的酯类增塑剂G:
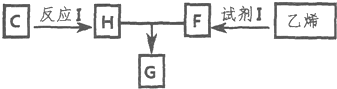
①试剂I是水.
②若生成G的反应中,消耗掉的H与F物质的量之比为1:2,则G的结构简式为
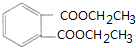 .
.
分析 A是苯的同系物,1molA与1mol苯分别完全燃烧时,A比苯多消耗3molO2,说明A比苯多-CH2CH2-原子团,A的核磁共振氢谱有3组峰,则A为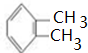 ;A和氯气在光照条件下发生取代反应生成B、X,B与X互为同分异构体,1molC发生银镜反应时最多可得到4molAg,说明一个C分子中含有两个醛基,B发生水解反应生成C,则B为
;A和氯气在光照条件下发生取代反应生成B、X,B与X互为同分异构体,1molC发生银镜反应时最多可得到4molAg,说明一个C分子中含有两个醛基,B发生水解反应生成C,则B为 ,C为
,C为 ;X和B是同分异构体,则X为
;X和B是同分异构体,则X为 ,X发生水解反应然后酸化得到D,则D为
,X发生水解反应然后酸化得到D,则D为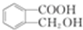 ,D发生缩聚反应生成高分子化合物的酯,故E为
,D发生缩聚反应生成高分子化合物的酯,故E为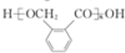 ;
;
(6)G是酯类增塑剂,应该是高分子酯类化合物,则H和F发生酯化反应生成G,H、F一个是羧酸、一个是醇,乙烯和水反应生成乙醇,若生成G的反应中,消耗掉的H与F物质的量之比为1:2,则H为羧酸,所以H为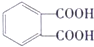 ,F为CH3CH2OH,G为
,F为CH3CH2OH,G为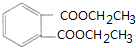 .
.
解答 解:A是苯的同系物,1molA与1mol苯分别完全燃烧时,A比苯多消耗3molO2,说明A比苯多-CH2CH2-原子团,A的核磁共振氢谱有3组峰,则A为 ;A和氯气在光照条件下发生取代反应生成B、X,B与X互为同分异构体,1molC发生银镜反应时最多可得到4molAg,说明一个C分子中含有两个醛基,B发生水解反应生成C,则B为
;A和氯气在光照条件下发生取代反应生成B、X,B与X互为同分异构体,1molC发生银镜反应时最多可得到4molAg,说明一个C分子中含有两个醛基,B发生水解反应生成C,则B为 ,C为
,C为 ;X和B是同分异构体,则X为
;X和B是同分异构体,则X为 ,X发生水解反应然后酸化得到D,则D为
,X发生水解反应然后酸化得到D,则D为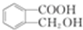 ,D发生缩聚反应生成高分子化合物的酯,故E为
,D发生缩聚反应生成高分子化合物的酯,故E为 .
.
(1)A为 ,A的名称是邻二甲苯或1,2-二甲苯,故答案为:邻二甲苯或1,2-二甲苯;
,A的名称是邻二甲苯或1,2-二甲苯,故答案为:邻二甲苯或1,2-二甲苯;
(2)X的结构简式为 ,故答案为:
,故答案为: ;
;
(3)C发生有机反应的离子方程式为: +4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$
+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$ +2NH4++4Ag+6NH3+2H2O,
+2NH4++4Ag+6NH3+2H2O,
故答案为: +4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$
+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$ +2NH4++4Ag+6NH3+2H2O;
+2NH4++4Ag+6NH3+2H2O;
(4)D发生缩聚反应生成E,反应的化学方程式为 ,
,
故答案为: ;
;
(5)D为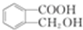 ,D的同分异构体符合下列条件,①能与浓溴水发生取代反应,说明含有酚羟基;②能发生水解反应说明含有酯基,如果取代基为-OH、-OOCHCH3,或者-OH、-CH2OOCH,或者-OH、-COOCH2,各有邻、间、对3种结构;如果含有-OH、-CHO、-CH3,-OH、-CHO有邻、间、对3种,对应的-CH3分别有4、4、2种,所以符合条件的有19种结构,其中核磁共振氢谱有5组峰的结构简式为
,D的同分异构体符合下列条件,①能与浓溴水发生取代反应,说明含有酚羟基;②能发生水解反应说明含有酯基,如果取代基为-OH、-OOCHCH3,或者-OH、-CH2OOCH,或者-OH、-COOCH2,各有邻、间、对3种结构;如果含有-OH、-CHO、-CH3,-OH、-CHO有邻、间、对3种,对应的-CH3分别有4、4、2种,所以符合条件的有19种结构,其中核磁共振氢谱有5组峰的结构简式为 ;
;
故答案为:19; ;
;
(6)G是酯类增塑剂,应该是高分子酯类化合物,则H和F发生酯化反应生成G,H、F一个是羧酸、一个是醇,乙烯和水反应生成乙醇,若生成G的反应中,消耗掉的H与F物质的量之比为1:2,则H为羧酸,所以H为 ,F为CH3CH2OH,G为
,F为CH3CH2OH,G为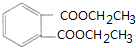 .
.
①试剂I是水,故答案为:水;
②G的结构简式为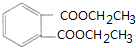 ,故答案为:
,故答案为: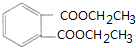 .
.
点评 本题考查有机物推断,侧重考查学生分析推断能力,正确判断A结构简式是解本题关键,结合反应条件分析推断,难点是(5)中同分异构体种类判断,要考虑位置异构、取代基异构.

| A. | 苯、溴水、铁粉混合制成溴苯 | |
| B. | 甲烷与氯气光照制得纯净的一氯甲烷 | |
| C. | 乙烯通入溴的四氯化碳溶液得到1,2-二溴乙烷 | |
| D. | 用高锰酸钾溶液除去乙烷中的乙烯杂质 |
| A. | C4H8N4 | B. | C6H12N4 | C. | C6H10N4 | D. | C4H10N4 |
| A. | 天然气是一种清洁的化石燃料 | |
| B. | 石油通过常压分馏可以得到石油气、汽油、煤油、柴油等 | |
| C. | 煤是由有机物和无机物组成的复杂的混合物 | |
| D. | 石油的裂化、裂解属于化学变化,煤的气化、液化则属于物理变化 |
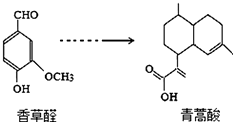
| A. | 在一定条件,香草醛可与HCHO发生缩聚反应 | |
| B. | 两种物质各1mol分别和氢气反应,最多消耗氢气4mol和3mol | |
| C. | 用FeCl3溶液可鉴别化合物香草醛和青蒿酸 | |
| D. | 青蒿酸分子中含有2个手性碳原子 |
| A. | 过氧化钠固体与水反应:2O22-+2H2O═OH-+O2↑ | |
| B. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| C. | 稀硝酸与过量的铁屑反应Fe+4H-+NO3-═Fe3++NO↑+2H2O | |
| D. | NaAlO2溶液中通入过量二氧化碳AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓ |
| A. | Li能在空气中燃烧 | B. | Li2O熔点较低 | ||
| C. | Li2CO3能溶于水 | D. | LiOH受热时易分解 |
| 实验序号 | ① | ② | ③ |
| 加入试剂(取等体积溶液) | 0.01mol/LKMnO4 0.1mol/LH2C2O4 | 0.01mol/LKMnO4 0.1mol/LH2C2O4 MnSO4固体 | 0.01mol/LKMnO4 0.1mol/LH2C2O4 Na2SO4固体 |
| 褪色时间/s | 116 | 6 | 117 |
(1)该实验结论是在其他条件相同时,Mn2+是草酸与酸性高锰酸钾反应的催化剂,起着加快反应速率的作用.
(2)还可以控制变量,研究哪些因素对该反应速率的影响:温度、浓度等.
(3)进行上述三个实验后,该同学进行反思,认为实验①的现象可以证明上述结论.请你写出实验①的现象并分析产生该现象的原因:KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快,因为反应生成的MnSO4是草酸与酸性高锰酸钾反应的催化剂,能加快化学反应速率.
(4)实验②选用MnSO4固体而不是MnCl2固体的原因是酸性KMnO4溶液具有强氧化性,能氧化氯化锰中的氯离子,也会使KMnO4溶液褪色,产生干扰.

