题目内容
12.锂原子比镁原子少1个电子层,最外层电子数也比镁原子少1,在周期表中锂和镁的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性.下列关于锂的判断可能正确的是( )| A. | Li能在空气中燃烧 | B. | Li2O熔点较低 | ||
| C. | Li2CO3能溶于水 | D. | LiOH受热时易分解 |
分析 在周期表中锂和镁的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性,所以根据镁元素的相关性质判断锂的有关性质,
A.Li与Mg的性质相似,可以在空气中燃烧;
B.Li2O属于离子化合物,锂离子半径小于镁离子半径,其熔点比MgO高;
C.根据碳酸镁的溶解性分析Li2CO3的溶解性;
D.根据Mg(OH)2性质分析LiOH的性质.
解答 解:在周期表中锂和镁的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性,所以根据镁元素的相关性质判断锂的有关性质,
A.Li与Mg的性质相似,可以在空气中燃烧生成Li2O,故A正确;
B.MgO熔点很高,可以用作耐火材料,而MgO、Li2O都属于离子化合物,锂离子半径小于镁离子半径,其熔点比MgO高,故B错误;
C.碳酸镁微溶于水,Li2CO3与碳酸镁性质相似,不溶于水,故C错误;
D.LiOH与Mg(OH)2性质相似,Mg(OH)2受热能分解,所以LiOH受热也易分解为氧化锂与水,故D错误,
故选A.
点评 本题考查了元素周期表知识,明确对角线规则是解本题关键,根据Mg及其化合物的性质利用知识迁移的方法分析解答,题目难度中等.

练习册系列答案
相关题目
2.向某密闭容器中加入0.3mol A、0.1mol C和一定量B的混合气体,在一定条件下发生反应,各物质的浓度随时间变化如图甲所示(t0~t1阶段的c(B)变化未画出),图乙为t2时刻改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段各改变一种不同的反应条件.下列说法中正确的是( )
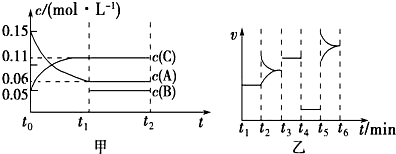

| A. | 若t1=15 s,t0~t1阶段B的平均反应速率为0.004 mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件是减小压强 | |
| C. | 该容器的容积为2 L,B的起始物质的量为0.02 mol | |
| D. | t5~t6阶段,容器内A的物质的量减少了0.06 mol,容器与外界的热交换为a kJ,则该反应的热化学方程式为3A(g)?B(g)+2C(g)△H=-50a kJ•mol-1 |
20.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列事实不能说明上述观点的是( )
| A. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| B. | 苯酚能与溴水反应,苯不能与溴水反应 | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 甲苯与溴蒸气(光照)发生取代反应,苯与液溴(铁做催化剂)发生取代反应 |
17.下列物质互为同素异形体的是( )
| A. | D2O与T2O | B. | 12C与13C | C. | O2与O3 | D. | 乙醇与二甲醚 |
4.对于A2+3B2?2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
| A. | v(B2)=0.8mol(L•s)-1 | B. | v(A2)=0.4 mol(L•s)-1 | ||
| C. | v(C)=0.6 mol(L•s)-1 | D. | v(D)=0.1 mol(L•s)-1 |
16.查阅资料:无水醋酸钠是无色无味的结晶体,在空气中可被风化,可燃.用无水醋酸钠与碱石灰加热可以制得X气体,并进行相应的实验:
(1)装置E中反应方程式是CH3COONa+NaOH$→_{△}^{CaO}$Na2CO3+X↑,X的化学式是CH4.
(2)在C中收集气体X和Cl2为1:1体积混合,然后在光照下反应:
①C装置所盛放液体试剂是饱和食盐水;
②B装置的作用是除去Cl2中含有的HCl;光照后所得产物有5种;
③装置D的作用是连通大气,平衡压强;接收可能溢出的液体;
(3)某学生为了测定X的组成进行实验探究,选用了F、G、H仪器:
①该同学依次连接的合理顺序是E、G、H、F;
②该同学测定的相关数据是:
数据是否完全,说明原因数据是不完全,因为只能确定有机物中的碳氢元素含量,不能确定是否含有氧元素,应称取C 装置实验前后的质量;
由以上数据可知X中碳氢两种原子的物质的量之比>(选填“>”、“<”)1:4,造成这种结果的原因是F 装置后面与空气接触,空气中的水蒸气和CO2进入了F 装置,造成含碳量偏大.

(1)装置E中反应方程式是CH3COONa+NaOH$→_{△}^{CaO}$Na2CO3+X↑,X的化学式是CH4.
(2)在C中收集气体X和Cl2为1:1体积混合,然后在光照下反应:
①C装置所盛放液体试剂是饱和食盐水;
②B装置的作用是除去Cl2中含有的HCl;光照后所得产物有5种;
③装置D的作用是连通大气,平衡压强;接收可能溢出的液体;
(3)某学生为了测定X的组成进行实验探究,选用了F、G、H仪器:
①该同学依次连接的合理顺序是E、G、H、F;
②该同学测定的相关数据是:
| 装置 | 实验前的质量/g | 实验后的质量/g |
| F | 22.5 | 33.6 |
| H | 42.4 | 51.4 |
由以上数据可知X中碳氢两种原子的物质的量之比>(选填“>”、“<”)1:4,造成这种结果的原因是F 装置后面与空气接触,空气中的水蒸气和CO2进入了F 装置,造成含碳量偏大.
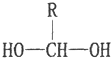 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$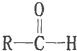

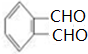 +4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$
+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$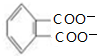 +2NH4++4Ag+6NH3+2H2O
+2NH4++4Ag+6NH3+2H2O .
. .
.
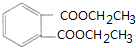 .
.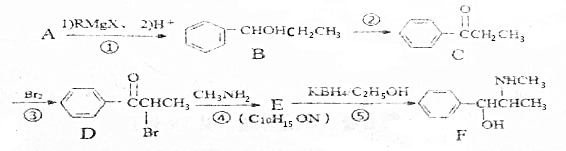
 (R、R′、R″均代表烃基;X代表卤素原子);
(R、R′、R″均代表烃基;X代表卤素原子); .
. .反应⑤的反应类型为还原反应.
.反应⑤的反应类型为还原反应. .
. (写反式结构)
(写反式结构)