题目内容
14.某共价化合物含C、H、N三种元素,分子内有4个N原子,且4个N原子排列成空间的四面体(如白磷分子结构),每2个N原子之间都有一个C原子,分子内无碳碳单键和碳碳双键,则该化合物分子式为( )| A. | C4H8N4 | B. | C6H12N4 | C. | C6H10N4 | D. | C4H10N4 |
分析 根据成键理论:碳周围4个键,氢周围1个键,氮周围三个键均是饱和的,据此来确定有机物的分子式.
解答 解:正四面体有6条边,所以有6个C原子,因为N原子构成正四面体的四个顶点,用完了三个共价键,所以不能再接H原子,每个C还有两个共价键可以和H原子结合,共要结合12个氢原子,即化合物的化学式是C6H12N4,故选B.
点评 本题主要考查学生有机物分子式的确定知识,注意原子的成键数目是解题的关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下表是元素周期表的一部分,列出11种元素在周期表中的位置,填写下列空白
(1)这11种元素中化学性质最不活泼的是Ar,金属性最强的是K.(写元素符号)
(2)第三周期元素中,原子半径最大的元素是(稀有气体元素除外)Na,离子半径最小的是Al,单质氧化性最强的元素是Cl.(写元素符号)
(3)J的简单离子的结构示意图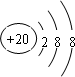 .
.
(4)D、E、F、K四元素的最高价氧化物对应水化物,按碱性依次减弱顺序排列为(写化学式)KOH>NaOH>Mg(OH)2>Al(OH)3.
(5)比较G、H两元素的最高价氧化物对应水化物的酸性HClO4>H2SO4.比较C、G两元素的气态氢化物稳定性HCl>H2S.(写化学式)
(6)C和D的单质在点燃条件下生成化合物的电子式为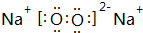 ,它属于离子(离子或共价)化合物.
,它属于离子(离子或共价)化合物.
(7)用电子式表示A和G所形成的简单化合物的形成过程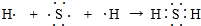 .
.
| 族 周期 | IA | IIA | IIIA | IV A | V A | VI A | VII A | O |
| 一 | A | |||||||
| 二 | B | C | ||||||
| 三 | D | E | F | G | H | I | ||
| 四 | K | J | ||||||
(2)第三周期元素中,原子半径最大的元素是(稀有气体元素除外)Na,离子半径最小的是Al,单质氧化性最强的元素是Cl.(写元素符号)
(3)J的简单离子的结构示意图
 .
.(4)D、E、F、K四元素的最高价氧化物对应水化物,按碱性依次减弱顺序排列为(写化学式)KOH>NaOH>Mg(OH)2>Al(OH)3.
(5)比较G、H两元素的最高价氧化物对应水化物的酸性HClO4>H2SO4.比较C、G两元素的气态氢化物稳定性HCl>H2S.(写化学式)
(6)C和D的单质在点燃条件下生成化合物的电子式为
 ,它属于离子(离子或共价)化合物.
,它属于离子(离子或共价)化合物.(7)用电子式表示A和G所形成的简单化合物的形成过程
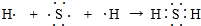 .
.
5.下列离子方程式书写正确的是( )
| A. | 硅与氢氧化钾溶液反应:Si+2OH-+H2O═SiO32-+2H2↑ | |
| B. | Al(OH)3溶于稀硝酸:OH-+H+═H2O | |
| C. | 往氨水中加入少量AlCl3溶液:Al3++4OH-═[Al(OH)4]- | |
| D. | 把水玻璃滴入盐酸中:SiO32-+2H+═H2SiO3 |
2.向某密闭容器中加入0.3mol A、0.1mol C和一定量B的混合气体,在一定条件下发生反应,各物质的浓度随时间变化如图甲所示(t0~t1阶段的c(B)变化未画出),图乙为t2时刻改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段各改变一种不同的反应条件.下列说法中正确的是( )
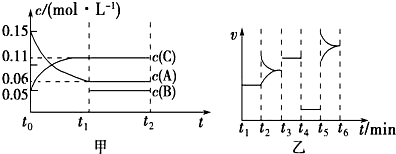

| A. | 若t1=15 s,t0~t1阶段B的平均反应速率为0.004 mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件是减小压强 | |
| C. | 该容器的容积为2 L,B的起始物质的量为0.02 mol | |
| D. | t5~t6阶段,容器内A的物质的量减少了0.06 mol,容器与外界的热交换为a kJ,则该反应的热化学方程式为3A(g)?B(g)+2C(g)△H=-50a kJ•mol-1 |
6.下列物质的性质比较,正确的是( )
| A. | 气态氢化物稳定性:HF>HCl | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:P>Cl | D. | 酸性:H2SO4>HClO4 |
4.对于A2+3B2?2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
| A. | v(B2)=0.8mol(L•s)-1 | B. | v(A2)=0.4 mol(L•s)-1 | ||
| C. | v(C)=0.6 mol(L•s)-1 | D. | v(D)=0.1 mol(L•s)-1 |
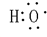 ;C22-(电子式)
;C22-(电子式) ;1,3-丁二烯(实验式)C2H3.
;1,3-丁二烯(实验式)C2H3.
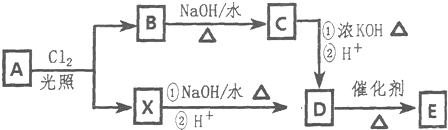
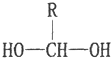 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$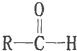

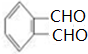 +4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$
+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$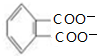 +2NH4++4Ag+6NH3+2H2O
+2NH4++4Ag+6NH3+2H2O .
. .
.
 .
.