题目内容
2.可以证明可逆反应N2+3H2?2NH3已达平衡状态的是:①一个N≡N键断裂的同时,有3个H-H键断裂;②一个N≡N键断裂的同时,有6个N-H键断裂;③其他条件不变时,混合气体的平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤ω(NH3)、ω(N2)和ω(H2)都不再改变;⑥恒温恒容时,密度保持不变;⑦v正(H2)=0.03mol•L-1•min-1,v逆(NH3)=0.02mol•L-1•min-1( )| A. | 全部 | B. | ②③④⑤⑥⑦ | C. | ②③④⑤⑦ | D. | 只有③④⑤⑥⑦ |
分析 反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,可以及由此衍生的一些量也不发生变化,由此进行判断.解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①无论是否达到平衡状态,只要一个N≡N断裂的同时,就有3个H-H键断裂,所以不能证明该反应达到平衡状态,故错误;
②反应达到平衡状态时,只要一个N≡N键断裂的同时,就有6个N-H键断裂,说明正逆反应速率相等,所以能证明该反应达到平衡状态,故正确;
③该反应达到平衡状态时,气体总物质的量不变,气体混合物的质量不变,所以其他条件不变时,混合气体平均相对分子质量不再改变,能说明该反应达到平衡状态,故正确;
④该反应是一个气体体积改变的反应,当反应达到平衡状态时,各物质的浓度不变,则其压强也不变,所以保持其他条件不变时,体系压强不再改变,能说明该反应达到平衡状态,故正确;
⑤反应达到平衡状态时,各物质的百分含量不变,所以ω(NH3)、ω(N2)和ω(H2)都不再改变能证明说明该反应达到平衡状态,故正确;
⑥该反应达到平衡状态时,气体总物质的量不变,气体混合物的质量不变,所以混合气体密度始终不改变,密度不变不能说明该反应达到平衡状态,故错误;
⑥v正(H2)=0.03mol•L-1•min-1,v逆(NH3)=0.02mol•L-1•min-1,说明正逆反应速率相等,所以能证明该反应达到平衡状态,故正确;
故选C.
点评 本题考查化学平衡状态的判断,题目难度不大,本题注意把握平衡状态的实质以及判断的依据.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
11.不能说明金属性Na>Mg>Al的是( )
| A. | 碱性NaOH>Mg(OH)2>Al (OH)3 | |
| B. | 原子半径Na>Mg>Al | |
| C. | 阳离子的氧化性Na+<Mg2+<Al3+ | |
| D. | Na与冷水剧烈反应,Mg与冷水反应微弱;镁粉与铝粉分别与同浓度稀HCl反应,镁粉比铝粉反应剧烈 |
12.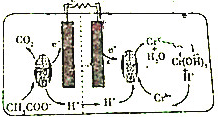 如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学品,下列有关说法正确的是( )
如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学品,下列有关说法正确的是( )
 如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学品,下列有关说法正确的是( )
如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学品,下列有关说法正确的是( )| A. | 该电池能够在高温下工作 | |
| B. | 得到的有价值的化学品为CO2和Cr(OH)3 | |
| C. | 右室中的电极为负极 | |
| D. | 1molCH3COO-转化为CO2得到4mol电子 |
10.下列各溶液与强酸溶液反应,不能用离子方程式HCO3-+H+=CO2↑+H2O 表示的是( )
| A. | 碳酸氢钾溶液 | B. | 纯碱溶液 | C. | 碳酸氢钙溶液 | D. | 小苏打溶液 |
7.乙炔分子CH≡CH加成可以得到CH2═CH-C≡CH(乙烯基乙炔),该物质是合成橡胶的重要原料.下列对该物质的判断中错误的是( )
| A. | 该物质与足量的H2加成后,只能生成一种物质 | |
| B. | 该物质既是CH2═CH2的同系物,又是CH≡CH的同系物 | |
| C. | 该物质既能使酸性KMnO4溶液褪色,又能使溴水褪色 | |
| D. | 该物质经加成,加聚后产物是氯丁橡胶(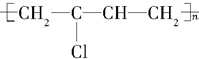 )的主要成分 )的主要成分 |
14.下列描述中正确的是( )
| A. | CS2为V形的极性分子 | |
| B. | Cl03- 的空间构型为平面三角形 | |
| C. | SF6中有6对完全相同的成键电子对 | |
| D. | SiF4和SO32- 的中心原子均为sp3杂化 |
11.氯有两种稳定的天然同位素37Cl、35Cl,已知它们的原子个数之比为3:1,则氯的相对分之质量为70、72、74的三种氯气分子的物质的量之比为( )
| A. | 6:6:1 | B. | 6:3:1 | C. | 3:3:1 | D. | 9:3:1 |
12.下列说法中,正确的是( )
| A. | 硅是不活泼的非金属元素,在自然界中可以以游离态的形式存在 | |
| B. | 传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐 | |
| C. | 铝制品在空气中有很强的抗腐蚀性是因为铝的化学性质不活泼 | |
| D. | 铝合金比纯铝的硬度更大、熔点更低 |