题目内容
15.下列变化中需要加入还原剂才能发生的是( )| A. | N2→NO2 | B. | N2→NH3 | C. | NO→NO2 | D. | NH3→NO |
分析 需要加入还原剂才能发生,则选项中为氧化剂的还原反应,氧化剂中某元素的化合价降低,以此来解答.
解答 解:A.N元素的化合价升高,需要加氧化剂,故A不选;
B.N元素的化合价降低,需要还原剂,故B选;
C.N元素的化合价升高,需要加氧化剂,故C不选;
D.N元素的化合价升高,需要加氧化剂,故D不选;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化剂发生还原反应,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列化学方程式中,能用离子方程式H++OH-→H2O表示的是( )
| A. | 2H2+O2 $\stackrel{点燃}{→}$2H2O | B. | 2HCl+Ba(OH)2→2BaCl2+H2O | ||
| C. | H2SO4+Cu(OH)2→CuSO4+2H2O | D. | Ba(OH)2+H2SO4→BaSO4↓+2H2O |
3.下列过程属于人工固氮的是( )
| A. | 分离液态空气制氮气 | B. | 闪电时氮气转化为NO | ||
| C. | 工业合成氨 | D. | 豆科植物根瘤菌将氮气转化为氨气 |
10.表所列为2007年6月在某报纸上公布的我国部分城市空气质量报告,解答下列有关问题
注:总悬浮颗粒物为TSP,氮氧化物为NOx,二氧化硫为SO2.
(1)表各城市中,空气质量最好的是厦门.
(2)酸雨是指pH<5.6的雨水,酸雨的主要成分是亚硫酸、硫酸.表中最容易出现酸雨的城市是重庆.为防止城市出现酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合使用.请写出有关“固硫”反应(不让硫的化合物进入大气)的化学方程式CaO+SO2═CaSO3,2CaSO3+O2═2CaSO4.
(3)汽车尾气中的CO,NO排放也是城市空气的污染物,治理的方法之一是在汽车的排气管上装一个“催化转化器”,使CO与NO反应,生成两种无毒气体,其中之一是N2.写出NO与CO反应的化学方程式2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,此反应的缺点是在一定程度上提高空气的酸度,其原因是使SO2转化成了SO3.
| 城市 | 北京 | 上海 | 天津 | 重庆 | 南京 | 厦门 | 珠海 | 汕头 | 济南 | 杭州 | 成都 |
| 污染指数 | 92 | 72 | 82 | 98 | 95 | 25 | 47 | 54 | 76 | 67 | 87 |
| 首要污染物 | TSP | NOx | TSP | SO2 | TSP | TSP | TSP | TSP | |||
| 空气级别 | Ⅱ | Ⅱ | Ⅱ | Ⅱ | Ⅱ | Ⅰ | Ⅰ | Ⅱ | Ⅱ | Ⅱ | Ⅱ |
(1)表各城市中,空气质量最好的是厦门.
(2)酸雨是指pH<5.6的雨水,酸雨的主要成分是亚硫酸、硫酸.表中最容易出现酸雨的城市是重庆.为防止城市出现酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合使用.请写出有关“固硫”反应(不让硫的化合物进入大气)的化学方程式CaO+SO2═CaSO3,2CaSO3+O2═2CaSO4.
(3)汽车尾气中的CO,NO排放也是城市空气的污染物,治理的方法之一是在汽车的排气管上装一个“催化转化器”,使CO与NO反应,生成两种无毒气体,其中之一是N2.写出NO与CO反应的化学方程式2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,此反应的缺点是在一定程度上提高空气的酸度,其原因是使SO2转化成了SO3.
20.可溶性的钡盐剧毒!误服0.8g的钡离子可以致人死亡.若误服了碳酸钡引起中毒症状,应立即服用解毒药剂,该解毒药剂可以是( )
| A. | KNO3 | B. | MgSO4 | C. | CaCl2 | D. | NaCl |
2.2016年3月“新视野”号冥王星探测器探测结果公布:冥王星表面有甲烷冰、氮冰、一氧化碳冰、水冰.下列说法不正确的是( )
| A. | CH4是含氢质量分数最高的有机物 | |
| B. | CH4、CO、H2O均属于共价化合物 | |
| C. | 实验室可用排水法收集CH4、CO、N2 | |
| D. | CO可用HCOOH制取,说明CO是酸性氧化物 |
19.某化学兴趣小组的成员捡到一块矿石,观察外观发现该矿石坚硬且呈红褐色,投入水中没有任何变化,再向水中加浓盐酸至过量,矿石部分溶解,并有大量无色气体产生.该兴趣小组的同学们猜测该矿石可能由CaCO3、SiO2、Fe2O3三种成分组成,试设计实验证明该矿石含除CaCO3以外的两种成分.
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、滴管、药匙、漏斗;2mol•L-1盐酸、2mol•L-1 NaOH溶液、2% KSCN溶液.
(1)将实验方案用如图所示流程图表示,试写出每步所用试剂的名称或化学式.
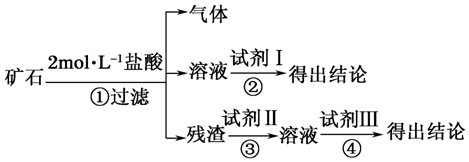
试剂Ⅰ2%的KSCN溶液;试剂Ⅱ2mol•L-1NaOH溶液;试剂Ⅲ2mol•L-1盐酸.
(2)如果猜测是成立的,试根据上述实验方案,完成实验操作、预期现象与结论.
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、滴管、药匙、漏斗;2mol•L-1盐酸、2mol•L-1 NaOH溶液、2% KSCN溶液.
(1)将实验方案用如图所示流程图表示,试写出每步所用试剂的名称或化学式.

试剂Ⅰ2%的KSCN溶液;试剂Ⅱ2mol•L-1NaOH溶液;试剂Ⅲ2mol•L-1盐酸.
(2)如果猜测是成立的,试根据上述实验方案,完成实验操作、预期现象与结论.
| 编号 | 实验操作 | 预期现象与结论 |
| ① | 取适量矿石研细,加足量2mol•L-1盐酸 | 有大量无色气体产生,得棕黄色溶液,且仍有少量固体残留 |
| ② | ||
| ③ | 取①操作残余固体适量置于烧杯,加入足量2mol•L-1NaOH溶液,充分搅拌 | 残余固体完全溶解于2mol•L-1NaOH溶液,并得无色溶液 |
| ④ |
20.下列对化学反应速率的叙述中错误的是( )
| A. | 化学反应速率是表示反应激烈程度的一个数据 | |
| B. | 反应速率是用单位时间内某反应物或生成物的浓度变化表示的 | |
| C. | 反应中不同物质单位时间内浓度变化来表示的同一个反应的速率,其数值可能不同 | |
| D. | 影响化学反应速率最大的因素是温度 |