题目内容
 某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是( )
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是( )| A、Br2的CCl4溶液 |
| B、Ag(NH3)2OH溶液 |
| C、HBr |
| D、H2 |
考点:有机物分子中的官能团及其结构
专题:有机物的化学性质及推断
分析:A.碳碳双键发生加成反应,醛基和溴发生氧化反应;
B.醛基和银氨溶液发生氧化反应生成羧基;
C.碳碳双键发生加成反应;
D.碳碳双键、醛基都发生加成反应.
B.醛基和银氨溶液发生氧化反应生成羧基;
C.碳碳双键发生加成反应;
D.碳碳双键、醛基都发生加成反应.
解答:
解:A.碳碳双键发生加成反应,醛基和溴发生氧化反应,所以增加溴原子,故A正确;
B.醛基和银氨溶液发生氧化反应生成羧基,官能团数目不变,故B错误;
C.碳碳双键和HBr发生加成反应,官能团由碳碳双键变为溴原子,HBr和醛基不反应,所以官能团数目不变,故C错误;
D.碳碳双键、醛基都发生加成反应,官能团数目减少,故D错误;
故选A.
B.醛基和银氨溶液发生氧化反应生成羧基,官能团数目不变,故B错误;
C.碳碳双键和HBr发生加成反应,官能团由碳碳双键变为溴原子,HBr和醛基不反应,所以官能团数目不变,故C错误;
D.碳碳双键、醛基都发生加成反应,官能团数目减少,故D错误;
故选A.
点评:本题考查了有机物的结构及性质,根据有机物中含有的官能团及其性质来分析解答,明确物质能发生哪些类型的反应,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 如图是周期表中短周期的一部分,X、Y、Z三种元素原子核外电子数之和等于Y的质量数,Y原子核内质子数与中子数相等,下列叙述不正确的是( )
如图是周期表中短周期的一部分,X、Y、Z三种元素原子核外电子数之和等于Y的质量数,Y原子核内质子数与中子数相等,下列叙述不正确的是( )| A、X元素最高价氧化物对应的水化物具有强氧化性和不稳定性 |
| B、Y元素的常见氧化物、气态氢化物的水溶液均是酸 |
| C、Z元素的单质能与水剧烈反应 |
| D、X、Y、Z的最高价含氧酸及气态氢化物的水溶液都是强酸 |
四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法不正确的是( )
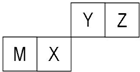

| A、M的离子半径小于Z的离子半径 |
| B、M和Y的最高价氧化物对应水化物之间能相互反应 |
| C、X的单质可以做光导纤维和半导体材料 |
| D、常温下,0.01mol/L的Y的气态氢化物的水溶液的pH=12 |
等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是( )
| A、FeO |
| B、Fe2O3 |
| C、FeSO4 |
| D、Fe3O4 |
对如图两种化合物的结构或性质描述正确的是( )


| A、不是同分异构体 |
| B、分子中共平面的碳原子数相同 |
| C、均能与溴水反应 |
| D、可用红外光谱区分,但不能用核磁共振氢谱区分 |
设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A、1mol甲苯含有6NA个C-H键 |
| B、18g H2O含有10NA个质子 |
| C、标准状况下,22.4L氨水含有NA个NH3分子 |
| D、56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
下列物质性质与应用对应关系正确的是( )
| A、晶体硅熔点高硬度大,可用于制作半导体材料 |
| B、氢氧化铝具有弱碱性,可用于制胃酸中和剂 |
| C、漂白粉在空气中不稳定,可用于漂白纸张 |
| D、氧化铁能与酸反应,可用于制作红色涂料 |
下列溶液中粒子的物质的量浓度关系正确的是( )
| A、0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| B、20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| C、室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) |
| D、0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |