题目内容
将3mol A和3mol B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)=xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,C的平均反应速率为0.1mol/(L?min).试求:
(1)5min后,C的物质的量为 .
(2)B的平均反应速率为 .
(3)x的值为 .
(4)5min后,A、B的物质的量之比为 .
(1)5min后,C的物质的量为
(2)B的平均反应速率为
(3)x的值为
(4)5min后,A、B的物质的量之比为
考点:化学平衡的计算
专题:化学平衡专题
分析:反应速率之比等于化学方程式计量数之比计算x值,D的浓度为0.5mol/L,D的速率为0.1mol/L?min,C的平均反应速率为0.1mol/(L?min),则x:2=0.1:0.1,x=2,依据化学三段式列式计算,D物质的量=0.5mol/L×2L=1mol,C物质的量=0.1mol/(L?min)×2L×5min=1mol,
3A(g)+B(g)=2C(g)+2D(g)
起始量(mol) 3 3 0 0
变化量(mol) 1.5 0.5 1 1
5min(mol) 1.5 2.5 1 1
依据计算结果分别计算各项.
3A(g)+B(g)=2C(g)+2D(g)
起始量(mol) 3 3 0 0
变化量(mol) 1.5 0.5 1 1
5min(mol) 1.5 2.5 1 1
依据计算结果分别计算各项.
解答:
解:反应速率之比等于化学方程式计量数之比计算x值,D的浓度为0.5mol/L,D的速率为0.1mol/L?min,C的平均反应速率为0.1mol/(L?min),则x:2=0.1:0.1,x=2,依据化学三段式列式计算,D物质的量=0.5mol/L×2L=1mol,C物质的量=0.1mol/(L?min)×2L×5min=1mol,
3A(g)+B(g)=2C(g)+2D(g)
起始量(mol) 3 3 0 0
变化量(mol) 1.5 1.5 1 1
5min(mol) 1.5 1.5 1 1
(1)5min后,C的物质的量为1mol,故答案为:1mol;
(2)B的平均反应速率=
=0.05mol/(L?min),故答案为:0.05mol/(L?min);
(3)上述计算x为2,故答案为:2;
(4)5min后,A、B的物质的量之比为1.5:2.5=3:5,故答案为:3:5.
3A(g)+B(g)=2C(g)+2D(g)
起始量(mol) 3 3 0 0
变化量(mol) 1.5 1.5 1 1
5min(mol) 1.5 1.5 1 1
(1)5min后,C的物质的量为1mol,故答案为:1mol;
(2)B的平均反应速率=
| ||
| 5min |
(3)上述计算x为2,故答案为:2;
(4)5min后,A、B的物质的量之比为1.5:2.5=3:5,故答案为:3:5.
点评:本题考查了化学平衡计算方法,主要是反应速率之比等于化学方程式计量数之比,化学反应速率概念计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
 某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是( )
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是( )| A、Br2的CCl4溶液 |
| B、Ag(NH3)2OH溶液 |
| C、HBr |
| D、H2 |
250C时,将乙酸溶液加入烧碱溶液中,当所得溶液的pH=7时,溶液中( )
| A、乙酸不足 |
| B、烧碱过量 |
| C、乙酸和烧碱等物质的量 |
| D、c(Na+)=c(CH3COO-) |
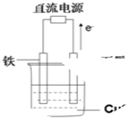 如图所示实验装置中,如果起始时盛有2000mL硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的c(H+)增加0.1mol/L,此时可观察到的现象是
如图所示实验装置中,如果起始时盛有2000mL硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的c(H+)增加0.1mol/L,此时可观察到的现象是 (1)写出该密闭容器发生反应的化学方程式为
(1)写出该密闭容器发生反应的化学方程式为