题目内容
下列物质性质与应用对应关系正确的是( )
| A、晶体硅熔点高硬度大,可用于制作半导体材料 |
| B、氢氧化铝具有弱碱性,可用于制胃酸中和剂 |
| C、漂白粉在空气中不稳定,可用于漂白纸张 |
| D、氧化铁能与酸反应,可用于制作红色涂料 |
考点:硅和二氧化硅,氯、溴、碘及其化合物的综合应用,镁、铝的重要化合物,铁的氧化物和氢氧化物
专题:元素及其化合物,化学应用
分析:A.硅位于非金属和金属分界线处,能制作半导体材料;
B.氢氧化铝具有弱碱性,能中和酸;
C.漂白粉具有漂白性,能漂白纸张;
D.氧化铁是红棕色固体,可以作红色涂料.
B.氢氧化铝具有弱碱性,能中和酸;
C.漂白粉具有漂白性,能漂白纸张;
D.氧化铁是红棕色固体,可以作红色涂料.
解答:
解:A.晶体硅熔点高硬度大可以制作玻璃刀等,硅位于金属和非金属分界线处,可用于制作半导体材料,二者没有关系,故A错误;
B.胃酸的主要成分是HCl,氢氧化铝具有弱碱性,能中和酸,二者有对应关系,故B正确;
C.漂白粉具有漂白性,能漂白纸张,与漂白粉的稳定性强弱无关,所以二者没有对应关系,故C错误;
D.氧化铁是红棕色固体,可以作红色涂料,氧化铁属于碱性氧化物,能溶于酸,可用用酸除锈,所以二者没有对应关系,故D错误;
故选B.
B.胃酸的主要成分是HCl,氢氧化铝具有弱碱性,能中和酸,二者有对应关系,故B正确;
C.漂白粉具有漂白性,能漂白纸张,与漂白粉的稳定性强弱无关,所以二者没有对应关系,故C错误;
D.氧化铁是红棕色固体,可以作红色涂料,氧化铁属于碱性氧化物,能溶于酸,可用用酸除锈,所以二者没有对应关系,故D错误;
故选B.
点评:本题考查了物质间的关系,明确物质的性质是解本题关键,根据其性质分析用途,掌握物质的性质,灵活运用知识解答,题目难度不大.

练习册系列答案
相关题目
 下列说法正确的是( )
下列说法正确的是( )| A、明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
| B、在Ca(ClO)2溶液中通入CO2,溶液一定变浑浊 |
| C、AgCl、AgBr、AgI均有感光性,其中AgI可用于人工降雨 |
| D、用如图所示装置吸收HCl |
每年的9月14日是“世界清洁地球日”.随着工业化的发展,工业废料和生活垃圾的日渐增多,地球有限的自净能力已难以承受日渐沉重的压力.如我们常用的泡沫快餐饭盒,由于它不能自行分解,对于地球来说,就是一种永远无法消除的“白色污染”.“白色污染”的危害主要有( )
①破坏土壤结构,降低土壤肥效 ②焚烧产生有毒气体污染环境 ③释放出氟氯代烷破坏臭氧层 ④危害动物⑤加剧温室效应 ⑥引起赤潮.
①破坏土壤结构,降低土壤肥效 ②焚烧产生有毒气体污染环境 ③释放出氟氯代烷破坏臭氧层 ④危害动物⑤加剧温室效应 ⑥引起赤潮.
| A、全部 | B、①②③④⑤ |
| C、③④⑤⑥ | D、①②⑤⑥ |
 某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是( )
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是( )| A、Br2的CCl4溶液 |
| B、Ag(NH3)2OH溶液 |
| C、HBr |
| D、H2 |
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A、pH=1的溶液中:Na+、K+、MnO4-、CO32- |
| B、c(H+)=1×10-13mol?L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- |
| C、0.1mol?L-1NH4HCO3溶液中:K+、Na+、NO3-、Cl- |
| D、0.1mol?L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为l:2,下列有关该有机物分子组成的推论正确的是( )
| A、分子中C、H、O个数之比为1:4:4 |
| B、分子中C、H个数之比为1:2 |
| C、分子中可能含有氧原子 |
| D、此有机物的最简式为CH4 |
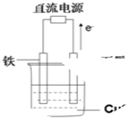 如图所示实验装置中,如果起始时盛有2000mL硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的c(H+)增加0.1mol/L,此时可观察到的现象是
如图所示实验装置中,如果起始时盛有2000mL硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的c(H+)增加0.1mol/L,此时可观察到的现象是