题目内容
3.下列说法不正确的是( )| A. | 标准状况下,等体积的CH4和CO2分子数相等 | |
| B. | 与NaOH溶液、稀硫酸反应产生等量的H2,所需铝粉的质量相等 | |
| C. | 常温下,铜与浓硫酸迅速反应产生SO2气体 | |
| D. | 1mol OH-和17g NH3所含的电子数相等 |
分析 A.相同条件下气体摩尔体积相同,则等体积的气体具有相同的物质的量及分子数;
B.Al在反应后产物中的化合价都是+3价,根据电子守恒分析;
C.铜与浓硫酸在加热条件下才能反应,常温下不反应;
D.氢氧根离子和氨气分子都属于10电子微粒,二者物质的量相等,则含有电子数相等.
解答 解:A.标准状况下气体摩尔体积相同,则等体积的CH4和CO2分子具有相同的物质的量,也具有相同的分子数,故A正确;
B.金属铝与氢氧化钠溶液、稀硫酸反应后产物中铝元素的化合价都是+3价,根据电子守恒生成等量氢气时消耗铝的物质的量一定相等,故B正确;
C.常温下,铜与浓硫酸不发生反应,必须在加热条件下二者才能产生SO2气体,故C错误;
D.1mol氢氧根离子中含有10mol电子,17g氨气的物质的量为1mol,也含有10mol电子,所以二者含有的电子数相等,故D正确;
故选C.
点评 本题考查了物质的量的简单计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积之间的关系为解答关键,注意掌握铜与浓硫酸的反应途径,试题有利于培养学生的灵活应用能力.

练习册系列答案
相关题目
14.下列元素中,金属活泼性最强的是( )
| A. | Na | B. | Mg | C. | Al | D. | Li |
12.下列离子方程式正确的是( )
| A. | 铁和稀HNO3反应后的溶液pH=1:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | 碳酸氢镁溶液中加入过量澄清石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ | |
| C. | 0.01 mol/L NH4Al(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 碳酸氢钠溶液与过量的澄清石灰水反应:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
13.光导纤维的主要成分是SiO2,下列叙述正确的为( )
| A. | SiO2的摩尔质量为60 | |
| B. | 标况下,15gSiO2的体积为5.6L | |
| C. | SiO2 中Si 和 O的质量比为7:8 | |
| D. | 相同质量的SiO2 和CO2中所含O原子的数目相同 |

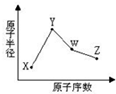 X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数表化如下图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.
X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数表化如下图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.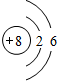 .
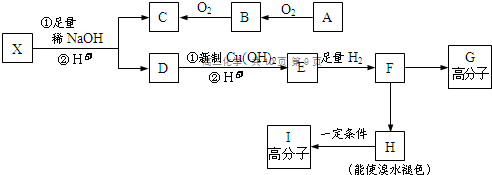
.
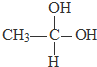 →CH3-CHO+H2O
→CH3-CHO+H2O ;
;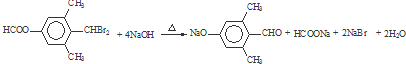 ;
;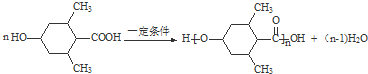 ;
;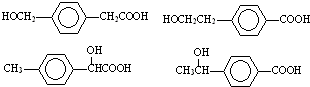 任意一种.
任意一种.


