题目内容
11.下列说法正确的是( )| A. | 为了使婴儿对食品有更浓厚的兴趣,应在婴儿食品中加入大量的着色剂 | |
| B. | 为了使火腿肠颜色更鲜红,可多加入一些亚硝酸钠 | |
| C. | 蛋白质在人体内经消化后生成碳酸、硫酸、尿酸等,故属于酸性食物 | |
| D. | 常用的抗酸药有氢氧化铜、氢氧化铝、柠檬酸钠、碳酸钙等 |
分析 A.着色剂添加过量对身体有害;
B、超标的亚硝酸钠能致癌;
C、食物进入人体后所生成的最终代谢物的产物呈酸性,成为酸性食物,通常含有丰富的蛋白质、脂肪和糖类;
D、氢氧化铜和胃酸作用后生成氯化铜,是重金属盐.
解答 解:A、婴儿抵抗力弱,婴儿食品安全第一,不能添加着色剂,故A错误;
B、亚硝酸钠有毒,食入0.3~0.5克即可引起中毒甚至死亡,故B错误;
C、食物进入人体后所生成的最终代谢物的产物呈酸性,成为酸性食物,通常含有丰富的蛋白质、脂肪和糖类,最终代谢产物碳酸、硫酸、尿酸均为酸性,故C正确;
D、氢氧化铜和胃酸作用后生成氯化铜,是重金属盐,能导致人中毒,故氢氧化铜不能做抗酸药,故D错误.
故选C.
点评 本题考查营养均衡和食品添加剂的正确使用,注意判断食物的酸碱性,并非根据人们的味觉、也不是根据食物溶于水中的化学性,而是根据食物进入人体后所生成的最终代谢物的酸碱性而定.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.欲配制pH=13.00的溶液10.0dm3,所需NaOH固体的质量是(相对原子质量:Na 23)( )
| A. | 40g | B. | 4.0g | C. | 4.0×10-11g | D. | 4.0×10-12g |
19.一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中“●”和“○”分别代表不同元素的原子.关于此反应说法不正确的是( )


| A. | 可能是双氧水分解反应 | |
| B. | 充分反应后,还有 物质,则属于可逆反应 物质,则属于可逆反应 | |
| C. | 反应前后,一定是共价键的断裂与生成 | |
| D. | 该反应可表示为: = = + +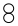 |
16.室温下.下列指定溶液中微粒的浓度关系正确的是( )
| A. | 0.1mol•L-1NH4Cl溶液中:c(CI-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 0.1mol•L-1Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) | |
| C. | 0.1mol•L-1Na2CO3溶液与同浓度等体积盐酸混合的溶液中:c(Na+)>c(CI-)>c(CO32-)>c(HCO3-) | |
| D. | 0.2mol•L-1H2C2O4(弱酸)与0.1mol•L-1NaOH溶液等体积混合的溶液中:2[c(H+)-c(OH-)]=3c(C2O42-)-c(H2C2O4)+c(HC2O4-) |
6.仅利用所提供实验器材(规格和数量不限),能完成相应实验的一项是( )
| 实验器材(省略夹持装置) | 相应实验 | |
| A | 烧杯、玻璃棒、蒸发皿 | 氯化钠溶液的蒸发结晶 |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去二氧化硅中的少量碳酸钙 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体硫酸钠配制0.1 mol/L的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| A. | A | B. | B | C. | C | D. | D |
16.下列事实,不能用勒夏特列原理解释的是( )
| A. | 向氯水中加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 对2HI(g)?H2(g)+I2(g)平衡体系,体积缩小,压强增大可使颜色变深 | |
| C. | 合成氨反应中用过量氮气与氢气反应可以提高氢气的转化率 | |
| D. | 将混合气中的氨气液化后不停的分离出来,有利于合成氨的反应 |
20.NH2OH(羟胺)是有机合成中常用的还原剂,是一元弱碱.25℃时,其电离平衡常数Kb=9.1×10-9.下列有关叙述错误的是( )
| A. | 羟胺中氮显-1价 | |
| B. | 羟胺的电子式为 | |
| C. | 硫酸羟胺的化学式为(NH3OH)2SO4 | |
| D. | 羟胺的电离方程式为NH2OH?NH2O-+H+ |
9.下列说法不正确的是( )
| A. | 氯气可用于漂白纸浆 | |
| B. | 热的纯碱溶液可以去除物品表面的油污 | |
| C. | 钠钾合金常温下是液体,可用于快中子反应堆的热交换剂 | |
| D. | 浓硫酸的吸水性,可使蔗糖炭化,实验室常用作干燥剂 |
 秋葵是一种大众喜爱的食材,含有蛋白质、维生素A、维生素C、纤维素、阿拉伯果糖和丰富的铁、锌、钙等元素,其中:
秋葵是一种大众喜爱的食材,含有蛋白质、维生素A、维生素C、纤维素、阿拉伯果糖和丰富的铁、锌、钙等元素,其中: