题目内容
13.下列叙述中不正确的是( )| A. | 镀锡的铁皮,破损后铁皮反而易被腐蚀 | |
| B. | 纯铁比生铁更易被腐蚀 | |
| C. | 金属的电化腐蚀比化学腐蚀普遍 | |
| D. | 金属腐蚀的本质是M-ne-=Mn+而被损耗 |
分析 A.形成原电池后的装置中,负极金属易被腐蚀,正极金属被保护;
B.生铁中含有碳、铁,易形成原电池;
C.金属的腐蚀以电化学腐蚀更普遍;
D.金属的腐蚀过程是金属失电子发生氧化反应的过程.
解答 解:A.Fe的活泼性强于锡,形成原电池时Fe作负极被腐蚀,所以镀锡的铁皮,破损后铁皮反而易被腐蚀,故A正确;
B.生铁中含有碳、铁,易形成原电池,发生电化学腐蚀,但是纯铁不易被腐蚀,生铁比纯铁更易被腐蚀,故B错误;
C.金属材料一般含有杂质,易形成原电池,所以金属的电化学腐蚀比化学腐蚀更普遍,故C正确;
D.金属的腐蚀过程就是金属失电子发生氧化反应的过程,本质是M-ne-=Mn+而被损耗,故D正确.
故选B.
点评 本题考查学生金属腐蚀的原理以及原电池的工作原理和金属的保护知识,注意基本知识的梳理和归纳很关键,难度不大,注意把握原电池正负极的判断.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如图所示.
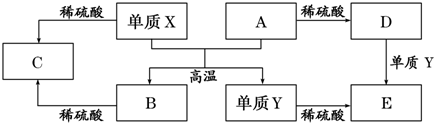
则下列说法正确的是( )

则下列说法正确的是( )
| A. | 单质Y在一定条件下能与水发生置换反应 | |
| B. | 向D溶液中滴加KSCN溶液,产生血红色沉淀 | |
| C. | X与A反应的化学方程式是 Al2O3+2Fe$\frac{\underline{\;高温\;}}{\;}$Fe2O3+2Al | |
| D. | 由于氧化物A和B均能与酸反应所以均是碱性氧化物 |
1.常温下,将pH=8的NaOH与pH=10的NaOH溶液等体积混合后,溶液后c(H+)最接近于( )
| A. | (10-8+10-10)mol/L | B. | (10-4+10-6)mol/L | C. | (10-8+10-9)mol/L | D. | 2×10-10mol/L |
8.下列物质中,在标准状况下,体积最大的是( )
| A. | 8gH2 | B. | 48gO2 | C. | 71gCl2 | D. | 1000gH2O |
18.常温下用 pH试纸测得氨水的pH等于12,则该溶液的物质的量浓度是( )
| A. | 12mol/L | B. | 1×10-12mol/L | C. | 0.01mol/L | D. | 大于0.01mol/L |
5.将质量分数为2P,密度为d(d>1g/cm3),物质的量浓度为2C的浓硫酸,用蒸馏水稀释到P,则其物质的量浓度( )
| A. | 大于C | B. | 小于C | C. | 等于C | D. | 不能确定 |
2.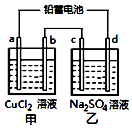 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2+4H++SO42-+4e-=PbSO4+2H2O | |
| C. | 若四个电极材料均为石墨,当析出6.4gCu时,消耗H2SO40.2mol | |
| D. | 甲池中阳离子向b极移动 |
7.下列说法或表示方法中,正确的是( )
| A. | 等质量的硫蒸气和硫黄固体分别完全燃烧,前者放出的热量多 | |
| B. | a℃、b kPa下,将0.5 mol O2和1.5 mol H2置于密闭容器中充分反应生成H2O(g),放热c kJ,其热化学方程式为2H2(g)+O2(g)=2H2O(g)△H=-2c kJ•mol-1 | |
| C. | 由N2O 4(g)?2NO2(g)△H=-56.9 kJ•mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ | |
| D. | 稀硫酸溶液与稀NaOH溶液反应的中和热为57.3 kJ•mol-1,则稀醋酸溶液与稀NaOH溶液反应的热化学方程式可表示为CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3 kJ•mol-1 |