题目内容
8.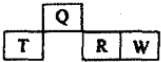 如图是元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是( )
如图是元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是( )| A. | 气态氢化物的稳定性:W>R | |
| B. | 元素T的最高价氧化物水化物可能是强碱 | |
| C. | Q的原子半径比T小 | |
| D. | W和Q的原子序数相差10 |
分析 图是元素周期表中短周期的一部分,四种元素中只有一种是金属,可知T为Al,Q为C,R为P,W为S,然后结合元素周期律来解答.
解答 解:图是元素周期表中短周期的一部分,四种元素中只有一种是金属,可知T为Al,Q为C,R为P,W为S,
A.非金属性W>R,则气态氢化物的稳定性:W>R,故A正确;
B.元素T的最高价氧化物水化物为氢氧化铝,为两性氢氧化物,故B错误;
C.电子层越多,原子半径越大,则Q的原子半径比T小,故C正确;
D.W和Q的原子序数相差16-6=10,故D正确;
故选B.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素周期律为解答的关键,侧重分析与应用能力的考查,注意T为Al为元素推断的突破口,题目难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
18.下列过程属于化学变化的是( )
| A. | 萃取分液 | B. | 石油的分馏 | C. | 蒸发结晶 | D. | 钢铁腐蚀 |
19.某无色溶液中含Na+、I-、NO3-、Cl-,加入下列哪种溶液不会使其变色( )
| A. | 酸化的淀粉溶液 | B. | 硫酸钠溶液 | C. | H2O2溶液 | D. | 氯水 |
16.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 L 0.1 mol•L-1的氨水中含有NH3•H2O分子数为0.1NA | |
| B. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| C. | 标准状况下,2.24 L的二氯甲烷中含有的碳氯共价键的数目为0.2NA | |
| D. | 一定条件下,4.6 g NO2和N2O4混合气体中含有的N原子数目为0.1NA |
3.A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如图所示.
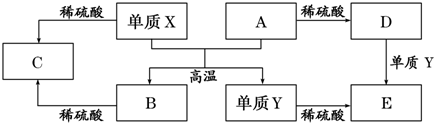
则下列说法正确的是( )

则下列说法正确的是( )
| A. | 单质Y在一定条件下能与水发生置换反应 | |
| B. | 向D溶液中滴加KSCN溶液,产生血红色沉淀 | |
| C. | X与A反应的化学方程式是 Al2O3+2Fe$\frac{\underline{\;高温\;}}{\;}$Fe2O3+2Al | |
| D. | 由于氧化物A和B均能与酸反应所以均是碱性氧化物 |
13.现有一瓶甲和乙的混合物,已知甲和乙的某些性质如表所示,据此,将甲和乙互相分离的方法是( )
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) | 水中溶解度 |
| 甲 | -98 | 57.5 | 0.93 | 可溶 |
| 乙 | -84 | 87 | 0.90 | 可溶 |
| A. | 蒸馏法 | B. | 结晶法 | C. | 萃取法 | D. | 过滤法 |
20.下列说法不正确的是( )
| A. | 某些金属、非金属元素化合时也能形成共价键 | |
| B. | 只有阴、阳离子间才能形成离子键 | |
| C. | 升温能加快钠与氧气反应生成氧化钠反应的速率 | |
| D. | FeCl2不能通过两种单质化合反应制得 |
17.元素在周期表中的位置,反映了元素的原子结构和元素的性质.下列说法正确的( )
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 | |
| C. | 短周期元素形成离子后,最外层都达到8电子稳定结构 | |
| D. | 第三周期主族元素的最高正化合价等于它所处的主族序数 |
18.常温下用 pH试纸测得氨水的pH等于12,则该溶液的物质的量浓度是( )
| A. | 12mol/L | B. | 1×10-12mol/L | C. | 0.01mol/L | D. | 大于0.01mol/L |