题目内容
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X、Y两元素最高正价与最低负价之和均为0;Q2-与R+的电子层结构相同.请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号) .
(2)X、Y、Q能形成多种化合物,其中相对分子质量最小的化合物的名称是 .
(3)X与R形成的化合物的电子式为: .
(4)由以上某些元素组成的物质A、B、C、D有如下转化关系:A
B,其中A为无色气体,B是有色物质,D是无色液体.写出B至A的可能的化学反应方程式: .
(1)五种元素原子半径由大到小的顺序是(写元素符号)
(2)X、Y、Q能形成多种化合物,其中相对分子质量最小的化合物的名称是
(3)X与R形成的化合物的电子式为:
(4)由以上某些元素组成的物质A、B、C、D有如下转化关系:A
| C |
| D |
考点:原子结构与元素的性质,原子结构与元素周期律的关系
专题:
分析:X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,Q2-与R+的电子层结构相同,若Q为O元素,则R为Na元素;若Q为S元素,则R为K元素,K不是短周期元素,故不符合,所以Q为O元素,R为Na元素;X、Y两元素最高正价与最低负价代数和均为0,原子序数均小于O元素,为ⅠA族H元素、ⅣA族元素,故X为H元素、Y为C元素;Z在C元素与O元素之间,则Z为N元素,据此分析.
解答:
解:X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,Q2-与R+的电子层结构相同,若Q为O元素,则R为Na元素;若Q为S元素,则R为K元素,K不是短周期元素,故不符合,所以Q为O元素,R为Na元素;X、Y两元素最高正价与最低负价代数和均为0,原子序数均小于O元素,为ⅠA族H元素、ⅣA族元素,故X为H元素、Y为C元素;Z在C元素与O元素之间,则Z为N元素,
(1)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Na>C>N>O>H,故答案为:Na>C>N>O>H;
(2)H、C、O能形成多种化合物,其中相对分子质量最小的化合物是HCHO,其名称是甲醛,故答案为:甲醛;
(3)X与R形成的化合物为NaHSO,属于离子化合物,其电子式为:Na+[:H]-,故答案为:Na+[:H]-;
(4)由以上某些元素组成的物质A、B、C、D有如下转化关系:A
B,其中A为无色气体,B是有色物质,D是无色液体,若A为氧气,B为过氧化钠,则C为Na,D为水;若A为NO,B为NO2,则C为氧气,D为水,B至A的可能的化学反应方程式:3NO2+H2O=2HNO3+NO、2Na2O2+2H2O=4NaOH+O2↑;
故答案为:3NO2+H2O=2HNO3+NO、2Na2O2+2H2O=4NaOH+O2↑.
(1)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Na>C>N>O>H,故答案为:Na>C>N>O>H;
(2)H、C、O能形成多种化合物,其中相对分子质量最小的化合物是HCHO,其名称是甲醛,故答案为:甲醛;
(3)X与R形成的化合物为NaHSO,属于离子化合物,其电子式为:Na+[:H]-,故答案为:Na+[:H]-;
(4)由以上某些元素组成的物质A、B、C、D有如下转化关系:A
| C |
| D |
故答案为:3NO2+H2O=2HNO3+NO、2Na2O2+2H2O=4NaOH+O2↑.
点评:本题考查了位置结构性质的相互关系及应用,侧重于学生分析能力的考查,本题涉及元素周期律、物质之间的转化等知识点,正确推断元素是解本题关键,根据元素在周期表中的位置及原子结构确定元素,再结合物质的性质来分析解答,题目难度中等.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
下列叙述正确的是( )
| A、合成氨工业中,移走NH3可增大正反应速率,提高原料转化率 |
| B、酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液 |
| C、将NO2、N2O4混合气体的体积压缩为原来的一半,则气体颜色加深 |
| D、牺牲阳极的阴极保护法和外加直流电源的阴极保护法都是应用电解原理 |
 “暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的.某老师在课堂上做了一个如右图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,则溶液呈血红色.则下列说法中不正确的是( )
“暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的.某老师在课堂上做了一个如右图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,则溶液呈血红色.则下列说法中不正确的是( )| A、在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” |
| B、该条件下H2燃烧的产物中可能含有一定量的H2O2 |
| C、该条件下H2燃烧生成了既具有氧化性又具有还原性的物质 |
| D、水凝固形成20℃时的“暖冰”所发生的变化是化学变化 |
下列有关阿伏加德罗常数NA的说法中,不正确的是( )
| A、标准状况下,分子数为NA的N2、C2H4混合气体的总质量为28g |
| B、0.1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数目为0.2NA |
| C、60gCaCO3与KHCO3的混合物与足量盐酸反应生成CO2分子数为0.6NA |
| D、常温常压下,将0.1mol氯气通入水中发生化学反应,转移电子数为0.1NA |
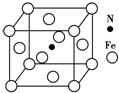 铁及其化合物在有机化学中应用广泛,例如有机合成中,常用铁和盐酸将硝基(-NO2)还原为氨基(-NH2);在苯的溴代反应中用溴化铁作催化剂.
铁及其化合物在有机化学中应用广泛,例如有机合成中,常用铁和盐酸将硝基(-NO2)还原为氨基(-NH2);在苯的溴代反应中用溴化铁作催化剂.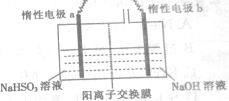 连二亚硫酸钠(Na2S2O4)俗称保险粉,具有强还原性,广泛用于纺织品漂白及作脱氧剂等.
连二亚硫酸钠(Na2S2O4)俗称保险粉,具有强还原性,广泛用于纺织品漂白及作脱氧剂等.