题目内容
氯酸钾跟盐酸反应生成氯气,化学方程式为:KClO3+6HCl(浓)→KCl+Cl2+H2O,若反应使用的是K37ClO3和H35Cl,则所得氯气的摩尔质量约 g/mol.
考点:摩尔质量
专题:计算题
分析:根据化学方程式为:KClO3+6HCl(浓)→KCl+5Cl2+H2O,若反应使用的是K37ClO3和H35Cl,分析氯气的组成,进而计算氯气的摩尔质量.
解答:
解:化学方程式为:KClO3+6HCl(浓)→KCl+5Cl2+H2O,若反应使用的是K37ClO3和H35Cl,生成Cl2的相对分子质量为
×2≈70.67,则所得氯气的摩尔质量约70.67g/mol,
故答案为:70.67.
| 37×1+35×5 |
| 1+5 |
故答案为:70.67.
点评:本题考查氯气的摩尔质量,题目难度不大.

练习册系列答案
相关题目
下列分子中的所有原子都在同一平面的是( )
| A、环己烷 | B、溴苯 | C、丙烯 | D、丁炔 |
具有相同数目氧原子的SO2和SO3,下列关系中一定正确的是( )
| A、n(SO2):n(SO3)=2:3 |
| B、V(SO2):V(SO3)=3:2 |
| C、m(SO2):m(SO3)=6:5 |
| D、Mr(SO2):Mr(SO3)=5:4 |
下图所示实验操作中,正确的是( )
A、 检查容量瓶是否漏水 |
B、 给液体加热 |
C、 滴加液体 |
D、 过滤 |
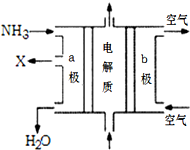 以下是对化学反应变化过程及结果的研究.按要求回答问题:
以下是对化学反应变化过程及结果的研究.按要求回答问题: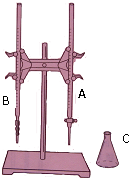 某同学利用如图装置,用0.1000mol/L的氢氧化钾溶液测定某未知浓度的盐酸溶液的物质的量浓度,其操作可分解为如下几步:
某同学利用如图装置,用0.1000mol/L的氢氧化钾溶液测定某未知浓度的盐酸溶液的物质的量浓度,其操作可分解为如下几步: