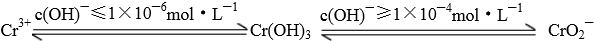题目内容
将两支惰性电极插入CuSO4溶液中,通电电解,当有1×10-3mol的OH-放电时,溶液显浅蓝色,则下列叙述正确的是( )
| A、阳极上析出5.6mL O2(标准状况) |
| B、阴极上析出64mg Cu |
| C、阴极上析出11.2mL H2(标准状况) |
| D、阳极和阴极质量都无变化 |
考点:电解原理
专题:电化学专题
分析:以惰性电极电解CuSO4溶液,阳极发生4OH--4e-═2H2O+O2↑,阴极发生2Cu2++4e-═2Cu,溶液显浅蓝色,说明只有部分铜离子放电,结合电子的转移计算该题.
解答:
解:A.阳极发生4OH--4e-═2H2O+O2↑,当有1×10-3mol的OH-放电时,生成氧气的体积为1×10-3mol×
×22.4L/mol=5.6mL,故A正确;
B.当有1×10-3mol的OH-放电时,转移1×10-3mol电子,则在阴极析出5×10-4molCu,质量为32mg,故B错误;
C.转移1×10-3mol电子,阴极析出铜,溶液显浅蓝色,说明铜离子部分放电,没有氢气析出,故C错误;
D.阴极析出铜,质量变化,故D错误.
故选A.
| 1 |
| 4 |
B.当有1×10-3mol的OH-放电时,转移1×10-3mol电子,则在阴极析出5×10-4molCu,质量为32mg,故B错误;
C.转移1×10-3mol电子,阴极析出铜,溶液显浅蓝色,说明铜离子部分放电,没有氢气析出,故C错误;
D.阴极析出铜,质量变化,故D错误.
故选A.
点评:本题考查电解原理及计算,明确发生的电极反应及硫酸铜的物质的量是解答本题的关键,为易错题,题目难度中等.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、碳酸钙和盐酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| B、向氢氧化钡溶液中加硫酸溶液:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
| C、向稀盐酸溶液中加铁:2Fe+6H+═2Fe3++3H2↑ |
| D、向硝酸银溶液中加盐酸:Ag++C1-═AgCl↓ |
下列说法中正确的是( )
| A、5.6g铁粉与硝酸反应失去的电子数一定为0.3NA | |||||
B、1.8g重水(D2O,D为
| |||||
| C、常温、常压下,22.4LNO2和N2O4混合气体中含有原子总数为3NA | |||||
| D、1mol/L的氨水与等质量的水混合后(忽略体积变化),所得溶液浓度大于0.5mol/L |
 将0.20mol NO和0.1mol CO充入一个容积恒定为1L的密闭容器中发生反应:
将0.20mol NO和0.1mol CO充入一个容积恒定为1L的密闭容器中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0在不同条件下,反应过程中部分物质的浓度变化如图所示.下列说法正确的是( )
| A、容器内的压强不发生变化说明该反应达到平衡 |
| B、当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K增大 |
| C、第12 min时改变的反应条件为升高温度 |
| D、向该容器内充入He气,容器内气体压强增大,所以反应速率增大 |
下列各项中的两种物质无论以何种比例混合,只要混合物的总物质的量一定.则完全燃烧时生成水的质量和消耗O2的质量均不变的是( )
| A、C3H6、C3H8O |
| B、C3H6、C2H6O |
| C、C2H2、C6H6 |
| D、CH4、C2H4O2 |
 某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物.
某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物.