题目内容
11.天然水资源的利用包括水资源的利用和化学资源的利用.(1)FeSO4•7H2O时常用的混凝剂,用以除去水中细小的悬浮物质和胶体,它在水中最终生成Fe(OH)3沉淀.
(2)如果水的硬度由碳酸氢钙和碳酸氢镁引起的,这种水的硬度叫暂时硬度写出这两种物质在水中与足量的氢氧化钙反应的离子方程式Ca2++HCO3-+OH-=CaCO3↓+H2O,Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+Mg(OH)2↓+2H2O.
(3)海水淡化的方法主要有蒸馏法、电渗析法、离子交换法(答三种).
(4)海水中的NaCl是重要化工原料,氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可节能30%以上,如图是该工艺图示(电极未标出),所用的离子膜都只允许阳离子通过,下列说法正确的是D,
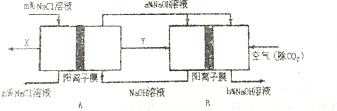
A.X为H2、Y为Cl2 B.A池尾电解池,且m<n
C.B池尾燃料电池,且a>b D.该工艺优点是节约能量且能提高烧碱产品浓度
(5)水在生产中也是不可缺少的原料.
①写出水和含氢质量分数最高的有机物反应制取H2的化学方程式:CH4+H2O$\frac{\underline{\;一定条件\;}}{\;}$3H2+CO.
②某化肥厂用①制得的H2在合成塔中与N2反应合成氨气,再用NH3制备NH4NO3,已知:由NH3制NO的产率是96%,NO制HNO3的产率是92%,则与HNO3反应所用去NH3的质量占总耗NH3质量的47%请你为硝酸厂的选址提出合理化建议原料与产品运输方便,生成动力来源充足,废物易于处理,地价较便宜等.
分析 (1)可以是胶体发生聚沉,氧化生成铁离子,进一步水解得到氢氧化铁胶体,吸附悬浮物质,最终生成氢氧化铁沉淀;
(2)水的硬度由碳酸氢钙和碳酸氢镁引起的,这种水的硬度叫暂时硬度;碳酸氢钙与足量的氢氧化钙反应生成碳酸钙与水,碳酸氢镁与足量的氢氧化钙反应生成碳酸钙、氢氧化镁与水;
(3)海水淡化的方法主要有:蒸馏法、电渗析法、离子交换法;
(4)B装置中通入空气和Y,空气作氧化剂,且整个装置是原电池和电解池组合的装置,B能自发的进行氧化还原反应,所以B是原电池,则A是电解池;
燃料电池中氢气是燃料,在负极上通入,空气是氧化剂,在正极上通入,负极上失电子发生氧化反应,正极上得电子发生还原反应,电解池中,电解氯化钠溶液时,阳极上氯离子放电生成X氯气,阴极上氢离子放电生成Y为氢气,同时得到氢氧化钠;
(5)①含氢质量分数最高的有机物为CH4,水和甲烷反应制取H2,还生成CO或二氧化碳;
②假设硝酸铵的物质的量为1mol,则与硝酸反应的氨气为1mol,根据原子守恒计算制备硝酸的氨气,每一步损失率、利用率都以氨气计算;
硝酸厂的选址应考虑运输、能源、污染问题、地价等方面因素.
解答 解:(1)硫酸亚铁属于电解质,可以是胶体发生聚沉,氧化生成铁离子,进一步水解得到氢氧化铁胶体,吸附细小的悬浮物质,最终生成氢氧化铁沉淀,
故答案为:细小的悬浮物质和胶体;Fe(OH)3;
(2)水的硬度由碳酸氢钙和碳酸氢镁引起的,这种水的硬度叫暂时硬度;碳酸氢钙与足量的氢氧化钙反应生成碳酸钙与水,离子方程式为:Ca2++HCO3-+OH-=CaCO3↓+H2O,
碳酸氢镁与足量的氢氧化钙反应生成碳酸钙、氢氧化镁与水,离子方程式为:Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+Mg(OH)2↓+2H2O,
故答案为:暂时硬度;Ca2++HCO3-+OH-=CaCO3↓+H2O,Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+Mg(OH)2↓+2H2O;
(3)海水淡化的方法主要有:蒸馏法、电渗析法、离子交换法,
故答案为:蒸馏法、电渗析法、离子交换法;
(4)根据图片知,B装置中通入空气和Y,空气作氧化剂,且整个装置是原电池和电解池组合的装置,B能自发的进行氧化还原反应,所以B是原电池,则A是电解池;
A.通过以上分析知,A是电解池,B是原电池,原电池中燃料是氢气,所以Y是氢气,则X是氯气,故A错误;
B.A是电解池,电解氯化钠过程中,氯化钠溶液被电解时生成氯气、氢气和氢氧化钠,所以导致溶液中氯化钠浓度降低,所以m>n,故B错误;
C.B是燃料电池,正极上氧气得电子和水反应生成氢氧根离子,导致正极区域氢氧化钠浓度增大,所以a<b,故C错误;
D.B装置是把化学能转变为电能的装置,属于原电池,且正极上氧气得电子和水反应生成氢氧根离子,导致正极区域氢氧化钠浓度增大,故D正确;
故选:D;
(5)①含氢质量分数最高的有机物为CH4,水和甲烷反应制取H2,还生成CO或二氧化碳,反应方程式为:CH4+H2O$\frac{\underline{\;一定条件\;}}{\;}$3H2+CO等,
故答案为:CH4+H2O$\frac{\underline{\;一定条件\;}}{\;}$3H2+CO等;
②假设硝酸铵的物质的量为1mol,则与硝酸反应的氨气为1mol,制备的硝酸为1mol,令制备硝酸的氨气为xmol,每一步损失率、利用率都以氨气计算,根据原子守恒,xmol×96%×92%=1mol,解得x=$\frac{10000}{96×92}$,则与HNO3反应所用去NH3的质量占总耗NH3质量的$\frac{\frac{10000}{96×92}mol}{1mol+\frac{10000}{96×92}mol}$×100%≈47%,
硝酸厂的选址应具备以下有利条件:原料与产品运输方便,生成动力来源充足,废物易于处理,地价较便宜等,
故答案为:47%;原料与产品运输方便,生成动力来源充足,废物易于处理,地价较便宜等.
点评 本题考查化学与技术、原电池与电解原理、多步反应的有关计算,属于拼合型题目,(5)中注意利用守恒思想计算,也可以利用关系式计算,难度中等.

| A. | 氯气通入水中Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硫化钠加入水中S2-+2H2O═H2S+2OH- | |
| C. | 冰醋酸加入水中CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 铁与水蒸气反应2Fe+3H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2 |
| A. | 等于8.0g | B. | 等于8.00g | C. | 大于8.0g | D. | 等于0.2g |
| A. | AY溶液的pH小于7 | |
| B. | AY溶液的pH小于BY溶液的pH | |
| C. | 稀释相同倍数,BX溶液的pH变化小于BY溶液 | |
| D. | 电离平衡常数K(BOH)小于K(HY) |
 现有部分短周期元素的性质或原子结构如表:
现有部分短周期元素的性质或原子结构如表:| 元素编号 | 元素性质或原子结构 |
| A | 原子序数最小的元素 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 最外层电子数比次外层电子数多3 |
| D | 单质的一种同素异形体是保护地球地表环境的重要屏障 |
| E | 最高正化合价为+7 |
| F | 第3周期元素原子半径 最大 |
 ;
;(2)写出E单质与水反应的离子方程式Cl2+H2O=H++Cl-+HClO;
(3)在101kPa下,BA4(g)、A2(g)、B(s)的燃烧热分别为:△H1=-890.3kJ/mol、△H2=-285.8kJ/mol和△H3=-393.5kJ/mol,则反应B(s)+2A2(g)=BA4(g)的热化学方程式为C(s)+2H2(g)=CH4(g)△H=-74.8kJ•mol -1,
(4)C的一种氢化物甲核外有18个电子,发射卫星时可用它作为燃料,用C2D4为氧化剂,甲(l)+C2D4(l)-C2(g)+A2D(g)
已知4g甲在上述反应中放出71kJ的热量,写出该反应的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1136KJ/mol.
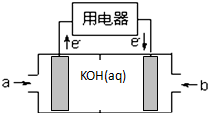
(5)BA4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,则a是CH4气体,电极反应式为CH4+10OH--8e-=2CO32-+7H2O;通入b气体的电极是正极,电极反应式为4H2O+2O2+8e-=8OH-.
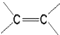 )中的π-键不能自由旋转,因此
)中的π-键不能自由旋转,因此 和
和 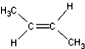 是两种不同的化合物,互为顺反异构体.则分子式为C3H2Cl4的化合物的链状异构体有( )
是两种不同的化合物,互为顺反异构体.则分子式为C3H2Cl4的化合物的链状异构体有( )