题目内容
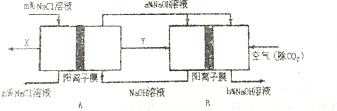
16.利用图中实验装置制取某无色非金属氧化物气体,请选择相应的序号填人括号中.
(1)烧瓶X中的药品应是D
A.铜与稀HN03
B.铜与浓HN03
C.CaC03与稀H2S04
D.Na2S03与浓盐酸
(2)洗气瓶Y中所装液体应是(不允许非水杂质混在气体中)C
A.浓H2SO4
B.Na0H溶液
C.饱和NaHS03溶液
D.NaHC03溶液
(3)检验集气瓶是否集满气体,置于瓶口的滤纸应沾上的溶液是B
A.BaCl2溶液
B.酸性KMn04溶液
C.KI淀粉
D.石灰水.
分析 (1)由反应的装置图可知,反应由固体和液体在不加热的条件下制备气体,经过洗气之后可用向上排空气法收集,说明气体的密度比空气大;
(2)制备二氧化硫气体中混有水蒸气和氯化氢气体,需要通过洗气瓶除去氯化氢,不允许非水杂质混在气体中,则选项中A浓硫酸只能吸收水蒸气,B吸收二氧化硫,D反应会生成二氧化碳;
(3)二氧化硫气体具有还原性可以使高锰酸钾溶液紫红色褪去.
解答 解:(1)A.铜和稀硝酸反应生成NO,不能用排空气法收集,故A错误;
B.铜和浓硝酸反应生成红棕色气体,不符合题目无色的要求,故B错误;
C.碳酸钙和硫酸反应生成的硫酸钙微溶于水,反应难以继续进行,故C错误;
D.亚硫酸钠和浓硫酸生成二氧化硫,无色,密度比空气大,有毒,可用如图装置制备,故D正确.
故答案为:D;
(2)制备二氧化硫气体中混有水蒸气和氯化氢气体,需要通过洗气瓶除去氯化氢,不允许非水杂质混在气体中,
A.浓硫酸只能吸收水蒸气不能吸收氯化氢,故A错误;
B.氢氧化钠溶液吸收二氧化硫,得不到二氧化硫气体,故B错误;
C.饱和NaHS03溶液可以吸收氯化氢反应生成二氧化硫,二氧化硫不反应,符合要求,故C正确;
D.NaHC03溶液可以吸收氯化氢和二氧化硫气体,同时反应会生成二氧化碳杂质气体,故D错误;
故答案为:C;
(3)检验集气瓶是否集满气体,置于瓶口的滤纸应沾上的溶液是和二氧化硫反应出现明显的现象,
A.BaCl2溶液遇到二氧化硫不反应无现象,不能检验二氧化硫,故A错误;
B.酸性KMn04溶液遇到二氧化硫会发生氧化还原反应,紫红色褪去,可以检验二氧化硫,故B正确;
C.KI淀粉溶液无色,和二氧化硫不反应,不能检验二氧化硫存在,故C错误;
D.石灰水可以吸收二氧化硫,但无明显的反应现象,故D错误;
故答案为:B.
点评 本题考查了实验室气体制备、气体收集、气体除杂等操作的分析,主要是试剂选择和反应过程的理解应用,掌握物质性质和实验基本操作是解题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | |
| B. | 非金属元素形成的化合物一定是共价化合物 | |
| C. | SO2通入Ca(ClO)2溶液中:SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl- | |
| D. | 只含有共价键的物质一定是共价化合物 |
 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A. | 反应的化学方程式为:N?2M | |
| B. | t2时,正逆反应速率相等,达到平衡 | |
| C. | t3时,正反应速率等于逆反应速率 | |
| D. | t3后,若升高温度则反应速率不一定增大 |
| A. | 2H2(g)+O2(g)═2H2O(l) | B. | H2(g)+Cl2(g)═2HCl(g) | ||
| C. | (NH4 )2 CO3(s)═NH4HCO3(s)+NH3(g) | D. | Cu(s)+Cl2(g)═CuCl2(s) |
| 实验序号 | 金属 质量/g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 4 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
(1)决定化学反应速率的因素是反应物本身的性质.
(2)实验1和2表明,固体反应物的表面积对反应速率有影响,而且,表面积越大,则反应速率越快;
(3)仅表明反应物浓度对反应速率产生影响的实验是1、3,而且,反应物的浓度越大,则反应速率越快;
(4)本实验中影响反应速率的其他因素还有温度,其实验序号是3、4(填实验序号);而且,温度越高,则反应速率越快;
(5)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:因为所有反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,故溶液温度变化值相近.
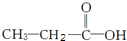 和
和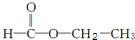 两种,为对其结构进行物理方法鉴定,常用红外光谱和核磁共振氢谱法.
两种,为对其结构进行物理方法鉴定,常用红外光谱和核磁共振氢谱法.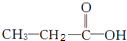 ,则红外光谱中应该有5个吸收峰;核磁共振氢谱中应有4个吸收峰.
,则红外光谱中应该有5个吸收峰;核磁共振氢谱中应有4个吸收峰. ,则红外光谱中应该有4个吸收峰;核磁共振氢谱中应有3个吸收峰.
,则红外光谱中应该有4个吸收峰;核磁共振氢谱中应有3个吸收峰.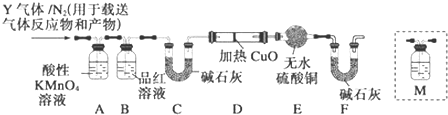


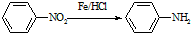 (苯胺,易被氧化)
(苯胺,易被氧化) ,F→G的反应类型是氧化反应.
,F→G的反应类型是氧化反应. .
. 的同分异构体的结构简式
的同分异构体的结构简式 .(写出2种)
.(写出2种) ,请设计合成路线,要求不超过4步(无机试剂任选).注:合成路线的书写格式参照如下示例流程图:CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4}}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
,请设计合成路线,要求不超过4步(无机试剂任选).注:合成路线的书写格式参照如下示例流程图:CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4}}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.