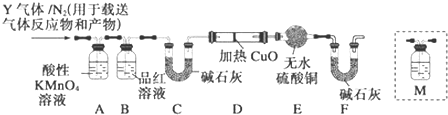
题目内容
19.下列表示物质变化的式子正确的是( )| A. | 氯气通入水中Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硫化钠加入水中S2-+2H2O═H2S+2OH- | |
| C. | 冰醋酸加入水中CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 铁与水蒸气反应2Fe+3H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2 |
分析 A.次氯酸为弱酸应保留化学式;
B.硫离子多元弱酸根离子,分步水解,用可逆号;
C.醋酸为弱酸,部分电离,用可逆号;
D.铁与水蒸气反应生成四氧化三铁和氢气.
解答 解:A.氯气通入水中,二者反应生成氯化氢和次氯酸,离子方程式:Cl2+H2O═H++Cl-+HClO,故A错误;
B.硫化钠加入水中,硫离子水解,离子方程式:S2-+H2O?HS-+OH-,故B错误;
C.醋酸为弱酸,部分电离,用可逆号,电离方程式:CH3COOH+H2O?CH3COO-+H3O+,故C正确;
D.铁与水蒸气反应生成四氧化三铁和氢气,化学方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,故D错误;
故选:C.
点评 本题考查了离子方程式、化学方程式的书写,侧重考查盐类水解、弱电解质电离,解题时注意弱电解质部分电离,用可逆号,多元弱酸根离子分步水解,以第一步为主.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
14.工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1;
已知:N-N键能193kJ•mol-1,N≡N键能946kJ•mol-1
(1)按照轨道重叠方式可知,N2分子中共价键类型为σ键、π键,其中较稳定的是π键.
(2)合成氨常用铁系催化剂,写出基态铁原子价电子排布图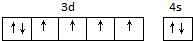 .
.
(3)在较高温度下,铁对氮气的强化学吸附是合成氨速率的决定步骤.其中一种吸附方式为: ,该吸附方式能加快反应速率的原因是氮氮三键变成了双键,结构发生改变.
,该吸附方式能加快反应速率的原因是氮氮三键变成了双键,结构发生改变.
(4)氨分子空间构型是三角锥,其氮原子采用的轨道杂化方式为sp3,氨是极性(填“极性”、“非极性”)分子,能与水分子形成氢键,易溶于水.固态氨是面心立方晶胞,有关数据如下表:
(5)固态氨晶体中氨分子的配位数12.
(6)列式计算固体氨的密度.
已知:N-N键能193kJ•mol-1,N≡N键能946kJ•mol-1
(1)按照轨道重叠方式可知,N2分子中共价键类型为σ键、π键,其中较稳定的是π键.
(2)合成氨常用铁系催化剂,写出基态铁原子价电子排布图
 .
.(3)在较高温度下,铁对氮气的强化学吸附是合成氨速率的决定步骤.其中一种吸附方式为:
 ,该吸附方式能加快反应速率的原因是氮氮三键变成了双键,结构发生改变.
,该吸附方式能加快反应速率的原因是氮氮三键变成了双键,结构发生改变.(4)氨分子空间构型是三角锥,其氮原子采用的轨道杂化方式为sp3,氨是极性(填“极性”、“非极性”)分子,能与水分子形成氢键,易溶于水.固态氨是面心立方晶胞,有关数据如下表:
| X射线衍射 | N-H键长 | N-N距离 | H-N-H键角 |
| 数据 | 101.9pm | 339.0pm | 107° |
(6)列式计算固体氨的密度.
4.下列离子方程式或说法正确的是( )
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | |
| B. | 非金属元素形成的化合物一定是共价化合物 | |
| C. | SO2通入Ca(ClO)2溶液中:SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl- | |
| D. | 只含有共价键的物质一定是共价化合物 |
8.判断下列反应的熵值增加的是( )
| A. | 2H2(g)+O2(g)═2H2O(l) | B. | H2(g)+Cl2(g)═2HCl(g) | ||
| C. | (NH4 )2 CO3(s)═NH4HCO3(s)+NH3(g) | D. | Cu(s)+Cl2(g)═CuCl2(s) |
9.如图,A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中D极产生具有氧化性的气体在标准状况下为2.24L.下列说法正确的是( )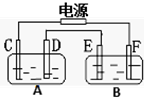

| A. | A池为电解池,B池为原电池 | B. | D、E两极都发生氧化反应 | ||
| C. | F极应为纯铜板材料 | D. | B池中E极质量增加12.8g |
 .
.