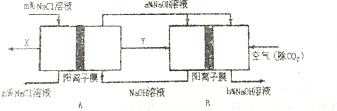
题目内容
3.配制浓度为2mol•L-1的NaOH100mL,用托盘天平称取NaOH固体时,天平读数将( )| A. | 等于8.0g | B. | 等于8.00g | C. | 大于8.0g | D. | 等于0.2g |
分析 依据n=CV计算需要氢氧化钠的质量,然后依据m=nM计算需要氢氧华钠的质量,注意托盘天平精确度为0.1g,据此解答.
解答 解:配制浓度为2mol•L-1的NaOH100mL,需要氢氧化钠的物质的量n=2mol/L×0.1L=0.2mol,其质量m=0.2mol×40g/mol=8.0g,
故选:A.
点评 本题考查了一定物质的量浓度溶液的配制,侧重考查有关物质的量计算,掌握基础即可解答,注意天平的精确度.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1;
已知:N-N键能193kJ•mol-1,N≡N键能946kJ•mol-1
(1)按照轨道重叠方式可知,N2分子中共价键类型为σ键、π键,其中较稳定的是π键.
(2)合成氨常用铁系催化剂,写出基态铁原子价电子排布图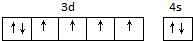 .
.
(3)在较高温度下,铁对氮气的强化学吸附是合成氨速率的决定步骤.其中一种吸附方式为: ,该吸附方式能加快反应速率的原因是氮氮三键变成了双键,结构发生改变.
,该吸附方式能加快反应速率的原因是氮氮三键变成了双键,结构发生改变.
(4)氨分子空间构型是三角锥,其氮原子采用的轨道杂化方式为sp3,氨是极性(填“极性”、“非极性”)分子,能与水分子形成氢键,易溶于水.固态氨是面心立方晶胞,有关数据如下表:
(5)固态氨晶体中氨分子的配位数12.
(6)列式计算固体氨的密度.
已知:N-N键能193kJ•mol-1,N≡N键能946kJ•mol-1
(1)按照轨道重叠方式可知,N2分子中共价键类型为σ键、π键,其中较稳定的是π键.
(2)合成氨常用铁系催化剂,写出基态铁原子价电子排布图
 .
.(3)在较高温度下,铁对氮气的强化学吸附是合成氨速率的决定步骤.其中一种吸附方式为:
 ,该吸附方式能加快反应速率的原因是氮氮三键变成了双键,结构发生改变.
,该吸附方式能加快反应速率的原因是氮氮三键变成了双键,结构发生改变.(4)氨分子空间构型是三角锥,其氮原子采用的轨道杂化方式为sp3,氨是极性(填“极性”、“非极性”)分子,能与水分子形成氢键,易溶于水.固态氨是面心立方晶胞,有关数据如下表:
| X射线衍射 | N-H键长 | N-N距离 | H-N-H键角 |
| 数据 | 101.9pm | 339.0pm | 107° |
(6)列式计算固体氨的密度.
8.判断下列反应的熵值增加的是( )
| A. | 2H2(g)+O2(g)═2H2O(l) | B. | H2(g)+Cl2(g)═2HCl(g) | ||
| C. | (NH4 )2 CO3(s)═NH4HCO3(s)+NH3(g) | D. | Cu(s)+Cl2(g)═CuCl2(s) |
 如图是A分子的球棍模型和B分子的比例模型,回答下列问
如图是A分子的球棍模型和B分子的比例模型,回答下列问