题目内容
10.下列物质不是常见的氧化剂的是( )| A. | O2 | B. | HNO3 | C. | KMnO4 | D. | CO |
分析 常见氧化剂所含元素化合价处于最高价态,具有氧化性,可从元素化合价的角度判断,以此解答.
解答 解:O2、HNO3、KMnO4中O、N、Mn元素化合价都为最高价态,具有氧化性,其中HNO3、KMnO4具有强氧化性,而CO中C元素化合价为+2价,处于中间价态,具有还原性,
故选D.
点评 本题考查氧化还原反应,侧重于学生的分析能的考查,题目难度不大,注意根据物质的性质判断所发生的反应,注意元素化合价的变化.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
20.Ⅰ.Fe3+具有氧化性,实验室测定含碘废液中I-的含量的过程如下:量取25.00mL废液于250mL锥形瓶中,分别加入5mL 2mol•L-1 H2SO4和10mL 20% Fe2(SO4)3溶液,摇匀.小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入几滴二苯胺磺酸钠(用作指示剂),用0.02500mol•L-1标准K2Cr2O7溶液进行滴定到终点.重复3次,数据记录如表:
(1)在盛有废液的锥形瓶中先加入5mL 2mol•L-1 H2SO4的目的是Fe3++3H2O?Fe(OH)3+3H+,加入H2SO4平衡逆向移动,抑制Fe3+水解.(用离子方程式和语言叙述解释)
(2)上述过程中涉及的反应:①2Fe3++2I-═2Fe2++I2②6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)根据滴定有关数据,该废液中I-含量是15.24g•L-1.
(4)在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是A.
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗衣后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡.
Ⅱ.Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点.某学习小组同学设计如下实验:
请回答:
(5)设计实验①的目的是排除NO3-的干扰.
(6)实验③可得出结论是Fe3+能氧化Ag.
(7)写出实验②中反应的离子方程式Fe2++Ag+?Fe3++Ag.
(8)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子浓度有关.
| 次数 | 1 | 2 | 3 |
| 滴定体积/mL | 19.98 | 20.02 | 19.00 |
(2)上述过程中涉及的反应:①2Fe3++2I-═2Fe2++I2②6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)根据滴定有关数据,该废液中I-含量是15.24g•L-1.
(4)在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是A.
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗衣后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡.
Ⅱ.Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点.某学习小组同学设计如下实验:
| 实验编号 | 实验操作 | 现象 |
| 1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 无白色沉淀生成 |
| 2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液 | 紫红色不褪去 |
| 3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 有白色沉淀生成 |
(5)设计实验①的目的是排除NO3-的干扰.
(6)实验③可得出结论是Fe3+能氧化Ag.
(7)写出实验②中反应的离子方程式Fe2++Ag+?Fe3++Ag.
(8)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子浓度有关.
1.X(g)+3Y(g)?2Z(g)△H=-a kJ•mol-1,一定条件下,将1mol X和3mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4mol.下列说法正确的是( )
| A. | 10min内,Y的平均反应速率为0.03 mol•L-1•min-1 | |
| B. | 第10min时,X的反应速率为0.01 mol•L-1•min-1 | |
| C. | 10min内,消耗0.1 mol X,生成0.4 mol Z | |
| D. | 10min内,X和Y反应放出的热量为a kJ |
5.下列物质属于碱的是( )
| A. | 苛性钠 | B. | 生石灰 | C. | 纯碱 | D. | 胆矾 |
15.M2O${\;}_{7}^{x-}$与S2-在酸性溶液中发生如下反应:M2O${\;}_{7}^{x-}$+3S2-+14H+═2M3++3S↓+7H2O,则M2O${\;}_{7}^{x-}$中M的化合价是( )
| A. | +1 | B. | +3 | C. | +4 | D. | +6 |
2.硼镁泥主要成份是MgO(占35%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质.从硼镁泥中提取MgSO4•7H2O的流程如下:
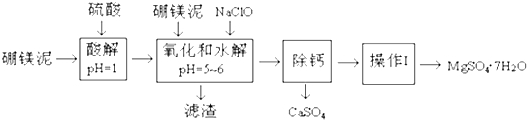
已知:NaClO与Mn2+反应产生MnO2沉淀.
根据题意回答第(1)~(5)题:
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:升温、把硼镁泥粉碎、搅拌等.
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O═MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有SiO2.
(4)已知MgSO4、CaSO4的溶解度如表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤是蒸发浓缩,趁热过滤.“操作I”是将滤液继续蒸发浓缩,冷却结晶,过滤洗涤干燥,便得到了MgSO4•7H2O.
(5)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,计算MgSO4•7H2O的产率为80.0%.

已知:NaClO与Mn2+反应产生MnO2沉淀.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:升温、把硼镁泥粉碎、搅拌等.
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O═MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有SiO2.
(4)已知MgSO4、CaSO4的溶解度如表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(5)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,计算MgSO4•7H2O的产率为80.0%.
20.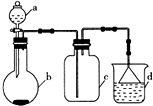 图为某些气体制备、收集及尾气处理装置.下列组合合理的是( )
图为某些气体制备、收集及尾气处理装置.下列组合合理的是( )
 图为某些气体制备、收集及尾气处理装置.下列组合合理的是( )
图为某些气体制备、收集及尾气处理装置.下列组合合理的是( )| a中液体 | b中物质 | c中气体 | D中液体 | |
| A | 浓氨水 | 生石灰 | NH3 | H2O |
| B | 浓硫酸 | 铜片 | SO2 | NaOH溶液 |
| C | 稀硫酸 | 硫化亚铁 | H2S | CuSO4溶液 |
| D | 饱和食盐水 | 电石 | C2H2 | 酸性KMnO4 |
| A. | A | B. | B | C. | C | D. | D |
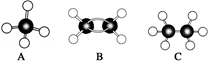 现有A、B、C三种烃,其球棍模型图:
现有A、B、C三种烃,其球棍模型图: