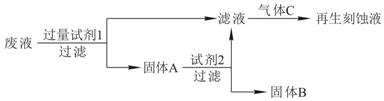
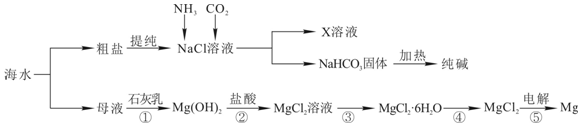
题目内容
12.在常温下,下列有关溶液中微粒的物质的量浓度关系不正确的是( )| A. | 0.1 mol•L-1 pH=7.82 的 NH4HCO3 溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1 mol•L-1 Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| C. | 浓度均为 0.1 mol•L-1的NH3•H2O 溶液和 NH4Cl 溶液等体积混合:c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| D. | 0.1 mol•L-1 Na2S 溶液与 0.1 mol•L-1 NaHS 溶液等体积混合:2c(Na+)-3c(S2-)=3c(HS-)+3c(H2S) |
分析 A.0.1 mol•L-1 pH=7.82 的 NH4HCO3 溶液显碱性,碳酸氢根离子水解程度大于铵根离子水解程度;
B.0.1 mol•L-1 Na2S溶液中存在质子守恒;
C.浓度均为 0.1 mol•L-1的NH3•H2O 溶液和 NH4Cl 溶液等体积混合溶液中一水合氨电离程度大于铵根离子水解程度,溶液显碱性,c(H+)>c(OH-),电荷守恒分析;
D.0.1 mol•L-1 Na2S 溶液与 0.1 mol•L-1 NaHS 溶液等体积混合后溶液中存在物料守恒,2n(Na)=3n(S);
解答 解:A.0.1 mol•L-1 pH=7.82 的 NH4HCO3 溶液显碱性,碳酸氢根离子水解程度大于铵根离子水解程度,c(NH4+)>c(HCO3-)>c(OH-)>c(H+),故A错误;
B.0.1 mol•L-1 Na2S溶液中存在质子守恒c(OH-)=c(H+)+c(HS-)+2c(H2S),故B正确;
C.浓度均为 0.1 mol•L-1的NH3•H2O 溶液和 NH4Cl 溶液等体积混合溶液中一水合氨电离程度大于铵根离子水解程度,溶液显碱性,c(H+)>c(OH-),电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-),浓度均为 0.1 mol•L-1的NH3•H2O 溶液和 NH4Cl 溶液等体积混合溶液中一水合氨电离程度大于铵根离子水解程度c(NH3•H2O)<c(Cl-),则得到c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-),故C正确;
D.0.1 mol•L-1 Na2S 溶液与 0.1 mol•L-1 NaHS 溶液等体积混合后溶液中存在物料守恒,2n(Na)=3n(S),2c(Na+)=3c(S2-)+3c(HS-)+3c(H2S),2c(Na+)-3c(S2-)=3c(HS-)+3c(H2S),故D正确;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及质子守恒的含义为解答关键,注意掌握盐的水解原理及其应用方法,试题培养了学生的灵活应用能力.

 考前必练系列答案
考前必练系列答案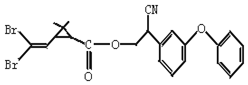
下列对该化合物叙述正确的是( )
| A. | 属于芳香烃 | B. | 属于卤代烃 | ||
| C. | 有两种含氧官能团 | D. | 含苯环不含碳碳双键 |
| A. | 2d | B. | 2.5d | C. | 5d | D. | 0.8d |
| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 1.00 | 0.70 | 0.50 | 0.20 | 0.20 |
| T2 | n(CH4)/mol | 1.00 | 0.60 | 0.36 | … | 0.30 |
| A. | T2时NO2的平衡转化率为70.0% | |
| B. | 该反应的△H<0、T1<T2 | |
| C. | 保持其他条件不变,T1时向平衡体系中再充入1.00molCH4和2.40molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小 | |
| D. | 保持其他条件不变,T1时向平衡体系中再充入0.60molCH4和1.60molH2O(g),平衡向正反应方向移动 |
| A. | 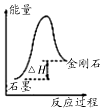 如图所示,从能量角度考虑,石墨比金刚石稳定 | |
| B. | 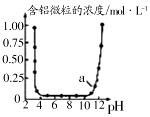 图表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+ | |
| C. | 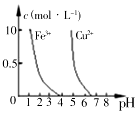 如图所示,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 | |
| D. | 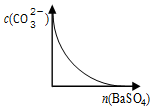 如图所示,在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的变化 |
| A. | 电子只能在电子云轮廓图中运动 | |
| B. | 能层不同,电子云轮廓图形状不相同 | |
| C. | 轨道数目相同,电子云轮廓图形状、大小完全相同 | |
| D. | 能层不同,能级相同,电子云轮廓图形状相同 |
| A. | 1.0×10-7 mol/L | B. | 1.0×107 mol/L | C. | $\frac{0.1}{a}$mol/L | D. | $\frac{0.1b}{a+b}$mol/L |
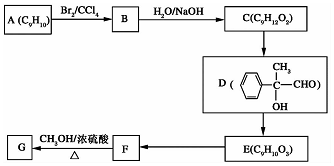
 .
.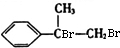 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$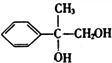 +2NaBr
+2NaBr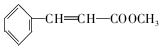 互为同分异构体
互为同分异构体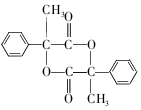 合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.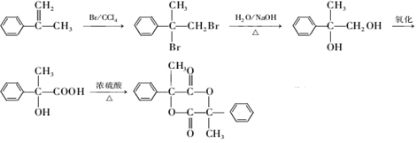 .
.