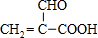题目内容
4.某地酸雨中可能含有下列离子:Na+、Mg2+、NH${\;}_{4}^{+}$、Cl-、SO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ 和NO${\;}_{2}^{-}$等.为确定其组成,分别进行下列4组实验:(已知:2MnO${\;}_{4}^{-}$+5NO${\;}_{2}^{-}$+6H+═2Mn2++5NO${\;}_{3}^{-}$+3H2O)A.取试样,滴加适量的淀粉KI溶液,呈蓝色:
B.取试样,滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;
C.取试样,滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;
D.取试样,滴加酸性KMnO4溶液,不褪色.
回答下列问题:
①其中能确认样品中不含SO${\;}_{3}^{2-}$的实验操作是D (填实验操作序号);
②根据实验结果,你认为是否含有NO${\;}_{2}^{-}$?不含有(填“含有”、“不含有”),其原因是样品中滴加酸性高锰酸钾溶液不褪色;
③写出A实验现象的离子方程2NO3-+6I-+8H+═2NO↑+3I2+4H2O,
④C实验说明酸雨中含NH4+.
分析 A.滴加适量的淀粉KI溶液,呈蓝色,说明在该酸性溶液中有一种能将碘离子氧化为碘单质的离子存在,而这样的离子只有NO3-,故一定含有NO3-,就一定不会含有SO32-、Fe2+;因为SO32-、Fe2+具有较强的还原性,酸性条件下,与NO3-不能共存;
B.滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出,故一定含有SO42-;
C.滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则有氨气生成,故一定含有NH4+;
D.取试样,滴加酸性KMnO4溶液,不褪色,可知溶液里无NO2-;
结合分析解题;
解答 解:A.滴加适量的淀粉KI溶液,呈蓝色,说明在该酸性溶液中有一种能将碘离子氧化为碘单质的离子存在,而这样的离子只有NO3-,故一定含有NO3-,就一定不会含有SO32-,因为SO32-具有较强的还原性,酸性条件下,与NO3-不能共存;
B.滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出,故一定含有SO42-;
C.滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则有氨气生成,故一定含有NH4+;
D.滴加酸性KMnO4溶液,不褪色,一定不含NO2-,若有NO2-,能使酸性KMnO4褪色,而氯离子的存在与否不能判断,因为硫酸根已经存在,据此分析解答;
①取试样,滴加酸性KMnO4溶液,不褪色,可知溶液里没有还原性强的SO32-,故答案为:D;
②溶液里不含有NO2-,原因是试样中滴加酸性KMnO4溶液,不褪色,而NO2-能使酸性KMnO4溶液褪色,故答案为:不含有;样品中滴加酸性高锰酸钾溶液不褪色;
③A实验中有I2生成,因此淀粉溶液呈蓝色,发生反应的离子方程为2NO3-+6I-+8H+═2NO↑+3I2+4H2O,故答案为:2NO3-+6I-+8H+═2NO↑+3I2+4H2O;
④C实验滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则有氨气生成,说明酸雨中一定含有NH4+,故答案为:NH4+.
点评 本题考查了常见离子的检验方法,题目难度中等,涉及离子推断、离子方程式、化学方程式书写等知识,明确常见离子的性质及检验方法为解答关键,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用能力.

| A. | SO${\;}_{4}^{2-}$ | B. | CO${\;}_{3}^{2-}$ | C. | Al3+ | D. | NO3- |

已知:几种金属离子沉淀的pH如表回答下列问题:
| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 7.8 | 10.4 |
A.适当升高温度 B.适当增大压强
C.研磨矿石 D.加入大量的蒸馏水
(2)溶浸过程中发生的主要反应是:FeS2与MnO2在稀硫酸中反应生成Fe3+、Mn2+、SO42-和H2O.在该反应配平的离子方程式中,氧化剂前面的化学计量数为15.
(3)除铁工序中,①先加入软锰矿,反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;
②再加入石灰的目的是3.7~5.2.
(4)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质.若测得滤液中c(Fˉ)=0.01mol•L-1,滤液中残留c(Ca2+)=1.5×10ˉ6mol•L-1,则Ksp(CaF2)=1.5×10ˉ10(mol3•L-3).
(5)沉锰工序中,298K、c(Mn2+)为1.05mol•L-1时,实验测得MnCO3的产率与溶液的pH、反应时间关系如图2所示.对比不同反应条件下的曲线,依据图中信息,你能获得的结论有:
①pH等于7.0时反应速率最快,且MnCO3产率最高;②pH越大越有利于提升MnCO3的产率.
(6)副产品A的主要成分是(NH4)2SO4.
| A. | 铁粉溶于稀盐酸中 2Fe+6H+═2Fe3++H2↑ | |
| B. | 钠和水反应 Na+H2O═Na++OH-+H2↑ | |
| C. | 用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 碳酸钙与稀硝酸反应:CO32-+2H+═H2O+CO2↑ |
| A. | K+、NO3-、OH-、Cl- | B. | Cu2+、SO42-、H+、Na+ | ||
| C. | H+、Ba2+、Mg2+、NO3- | D. | NH4+、MnO4-、H+、K+ |
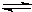 Fe(OH)3(胶体)+3H+.
Fe(OH)3(胶体)+3H+.