题目内容
13.下列离子方程式书写正确的是( )| A. | 铁粉溶于稀盐酸中 2Fe+6H+═2Fe3++H2↑ | |
| B. | 钠和水反应 Na+H2O═Na++OH-+H2↑ | |
| C. | 用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 碳酸钙与稀硝酸反应:CO32-+2H+═H2O+CO2↑ |
分析 A.不符合反应客观事实;
B.原子个数不守恒;
C.二者反应生成氯化钠、次氯酸钠和水;
D.碳酸钙为沉淀,应保留化学式.
解答 解:A.铁粉溶于稀盐酸中生成氯化亚铁和氢气,离子方程式:Fe+2H+═Fe2++H2↑,故A错误;
B.钠和水反应,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.用氢氧化钠溶液吸收多余的Cl2,离子方程式:Cl2+2OH-═Cl-+ClO-+H2O,故C正确;
D.碳酸钙与稀硝酸反应,离子方程式:CaCO3+2H+═H2O+CO2↑+Ca2+,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式的拆分,注意离子方程式遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
相关题目
9.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 在常温、常压下,11.2L N2含有的分子数为0.5 NA | |
| B. | 0.5 NA个氯气分子的物质的量是0.5mol | |
| C. | 标准状况下,18g H2O的体积是22.4L | |
| D. | 0.1 mol•L-1稀硫酸中含硫酸根个数为0.1NA |
1.下列各组物质的最简式相同的是( )
| A. | 乙酸和乙二醇 | B. | 乙醚和乙醇 | C. | 甲醛和乙酸 | D. | 乙醛和丙酮 |
8.甲~庚等元素在元素周期表中的相对位置如下表,己的最高价氧化物对应的水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数,下列判断正确的是( )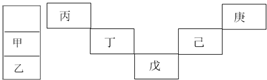

| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,甲和乙的单质均能与水剧烈反应 | |
| D. | 丁的最高价氧化物可广泛可于太阳能电池 |
18.对水的电离平衡不产生影响的粒子是( )
| A. | HCl | B. | CH3COO- | C. | SO42- | D. | Fe3+ |
5.提纯含有少量Ba(NO3)2杂质的KNO3溶液,可以使用的方法为( )
| A. | 加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 | |
| B. | 加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 | |
| C. | 加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 | |
| D. | 加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
2.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 常温常压下,71g Cl2中所含分子数为NA | |
| B. | 0.1mol/L的H2SO3溶液中,c(H+):c(SO32-)>2:1 | |
| C. | 2L 0.6mol/L的Fe2(SO4)3溶液中,含Fe3+离子总数为2.4NA | |
| D. | 1molNa与足量的O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
 .
.