题目内容
17.将少量的CO2通入下列溶液中,不能产生沉淀的是( )| A. | 氯化钙溶液 | B. | 石灰水 | C. | 氢氧化钡溶液 | D. | 硅酸钠溶液 |
分析 石灰水、氢氧化钡溶液、硅酸钠溶液都能够与二氧化碳反应,而碳酸钙溶于盐酸,则氯化钙溶液不能与二氧化碳反应,据此进行解答.
解答 解:A.碳酸钙溶于盐酸,则氯化钙溶液不与二氧化碳气体反应,故A正确;
B.石灰水与二氧化碳反应生成碳酸钙沉淀,故B错误;
C.氢氧化钡溶液与二氧化碳反应生成碳酸钡沉淀,故C错误;
D.硅酸钠溶液与二氧化碳反应生成硅酸沉淀,故D错误;
故选A.
点评 本题考查了离子反应及其应用,题目难度不大,明确离子反应发生条件为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
8.(1)已知Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验一如下(所取溶液体积均为10mL):
其他条件不变时:探究温度对化学反应速率的影响,应选择实验①⑤或②④(填实验编号);
若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究比较改变不同反应物的浓度对反应速率的影响对化学反应速率的影响.
(2)在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5min后测得N2的转化率为50%,则该段时间用H2表示的反应速率为$\frac{3a}{5V}$ mol/(L•min).
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大.
(3)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是催化剂(或硫酸锰或Mn2+的催化作用)的影响.
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B(填字母序号).
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/(mol•L-1) | c(H2SO4)/(mol•L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究比较改变不同反应物的浓度对反应速率的影响对化学反应速率的影响.
(2)在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5min后测得N2的转化率为50%,则该段时间用H2表示的反应速率为$\frac{3a}{5V}$ mol/(L•min).
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大.
(3)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是催化剂(或硫酸锰或Mn2+的催化作用)的影响.
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B(填字母序号).
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
12.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=xkJ•mol-1
已知:碳的燃烧热△H1=akJ•mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=bkJ•mol-1
S(s)+2K(s)═K2S(s)△H2=ckJ•mol-1,则x为( )
S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=xkJ•mol-1
已知:碳的燃烧热△H1=akJ•mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=bkJ•mol-1
S(s)+2K(s)═K2S(s)△H2=ckJ•mol-1,则x为( )
| A. | a+b-c | B. | c-3a-b | C. | 3a-b+c | D. | c-a-b |
2.下列有关说法不正确的是( )
| A. | 羊毛、棉花、淀粉都是自然界存在的天然高分子化合物 | |
| B. | 生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为铜离子 | |
| C. | 某反应的△H>0、△S<0,则该反应一定不能正向进行 | |
| D. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 |
9.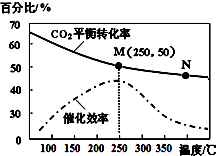 一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )
一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )
 一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )
一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)有可能小于v(N) | |
| B. | 当温度高于250℃时,升高温度,平衡向逆反应方向移动,催化剂的催化效率降低 | |
| C. | 平衡常数:KM<KN | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点乙烯的体积分数为15.4% |
7.根据杂化轨道理论判断下列分子的空间构型是V形的是 ( )(填写序号)
| A. | BeCl2 | B. | H2O | C. | HCHO | D. | CS2 |
 某有机物X的键线式为
某有机物X的键线式为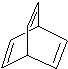 .
.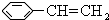 ,
, .
.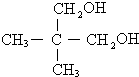 .
.