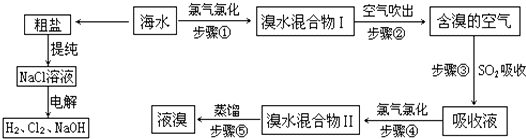
题目内容
10.25℃时,等体积等浓度的NaHCO3和Na2CO3溶液中,下列判断错误的是( )| A. | 均存在电离平衡 | B. | 阴离子数目前者大于后者 | ||
| C. | c(OH-)前者小于后者 | D. | 存在的粒子种类相同 |
分析 A、任何溶液中均存在水的电离平衡,在水溶液中碳酸氢根存在电离平衡和水解平衡;
B、CO32-的水解会导致阴离子个数增多;
C、碳酸根的水解程度大于碳酸氢根,水解规律:谁强显谁性;
D、根据溶液中存在的微粒来回答;
解答 解:A、Na2CO3溶液中存在水的电离平衡和碳酸根的水解平衡,NaHCO3在水溶液中存在碳酸氢根的电离平衡和水解平衡以及水的电离平衡,故A正确;
B、如果不考虑水解的话,则等浓度的NaHCO3和Na2CO3溶液中阴离子的数目相等,但CO32-的水解会导致阴离子个数增多,故阴离子的数目后者大,故B错误;
C、碳酸根的水解程度大于碳酸氢根,二者水解均显碱性,跟据水解规律:谁强显谁性,所以碳酸钠中的氢氧根浓度大于碳酸氢钠溶液中的氢氧根浓度,故C正确;
D、NaHCO3和Na2CO3溶液中存在的微粒均为:碳酸根、碳酸氢根、氢氧根、氢离子、碳酸分子、水分子,存在的粒子种类相同,故D正确.
故选B.
点评 本题考查盐的水解的应用,明确水解原理及盐类水解规律的应用是解题的关键,难度不大.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
5.常温下,将体积均为10mL,pH均为11的 NaOH和CH3COONa溶液加水稀释,pH变化如图所示,下列结论正确的是( )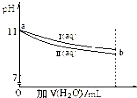

| A. | I 和 II 溶液中,离子种类数相同 | |
| B. | a 点处,I 溶液的浓度为 10-3mol?L-1 | |
| C. | a 点处,I、II 对水的电离平衡影响相同 | |
| D. | b 处的 I、II 溶液分别与盐酸反应,I 消耗 HCl 物质的量比 II 多 |
15.下列应用与盐类的水解无关的是( )
| A. | 纯碱溶液可去除油污 | |
| B. | 用NaHCO3溶液和Al2(SO4)3溶液可以制作泡沫灭火剂 | |
| C. | TiCl4溶于大量水加热制备TiO2 | |
| D. | 用锌粒与稀硫酸反应制取氢气时滴加少量CuSO4溶液 |
19.下列说法或叙述中正确的是( )
| A. | 硫酸、纯碱、氯酸钾、氧化钠分别属于酸、碱、盐、碱性氧化物 | |
| B. | 将饱和FeCl3溶液滴入NaOH溶液中,加热煮沸,可制得Fe(OH)3胶体 | |
| C. | 反应8NH3+3Cl2═N2+6NH4Cl中,氧化剂与还原剂物质的量之比是3:2 | |
| D. | 氯气的水溶液能导电,因此氯气属于电解质 |
5.下列互为同位素的是( )
| A. | 金刚石和石墨 | B. | ${\;}_{17}^{35}$CL和${\;}_{17}^{37}$CL | ||
| C. | 乙烷和丙烷 | D. | T2O和D2O |