题目内容
15.下列应用与盐类的水解无关的是( )| A. | 纯碱溶液可去除油污 | |
| B. | 用NaHCO3溶液和Al2(SO4)3溶液可以制作泡沫灭火剂 | |
| C. | TiCl4溶于大量水加热制备TiO2 | |
| D. | 用锌粒与稀硫酸反应制取氢气时滴加少量CuSO4溶液 |
分析 A、纯碱水解显示碱性,能够促进油污的水解;
B、NaHCO3与Al2(SO4)3两种溶液混合会迅速产生二氧化碳;
C、TiCl4溶于大量水,发生了水解:TiCl4+(2+x)H2O?TiO2•xH2O+4HCl;
D、锌与置换出的铜能形成铜锌原电池.
解答 解:A、纯碱水解,溶液显碱性,有利于油脂的水解,与盐类水解有关,故A错误;
B、NaHCO3与Al2(SO4)3两种溶液混合,碳酸氢根离子和铝离子发生双水解反应,会迅速产生二氧化碳,与盐类的水解有关,故B错误;
C、TiCl4溶于大量水发生反应TiCl4+(2+x)H2O?TiO2•xH2O+4HCl,加入大量水并加热,HCl挥发,促使水解正向进行,与水解有关,故C错误;
D、锌和滴入的硫酸铜反应置换出铜,形成铜锌原电池,加快反应速率,与水解无关,故D正确.
故选D.
点评 本题主要考查了盐类水解知识,同时还涉及酯的水解知识,侧重于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
5.下列过程有热量放出的是( )
| A. | 醋酸的电离 | B. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 | ||
| C. | 焦炭与二氧化碳气体发生的反应 | D. | Na与H2O反应 |
6.某工厂的电镀污泥中含有铜、铁等金属化合物.为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
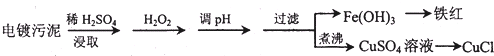
(1)酸浸后加入H2O2的目的是将Fe2+氧化成Fe3+,便于调整pH值与Cu2+分离.调pH步骤中加入的试剂最好是CuO、或Cu(OH)2、或CuCO3(填化学式).实验室进行过滤操作所用到的玻璃仪器有漏斗、烧杯、玻璃棒.
(2)向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4.
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准.称取所制备的CuCl样品0.2500g置于一定量的0.5mol/LFeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol/L的Ce(SO4)2溶液滴定,到达滴定终点时消耗Ce(SO4)2溶液24.60mL.有关的化学反应为:Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+,通过计算说明该CuCl样品符合(填“符合”或“不符合”)国家标准.
(4)25℃时,Ksp[Fe(OH]3]=4.0×10-38.Fe3+发生水解反应Fe3++3H2O?Fe(OH)3+3H+,该反应的平衡常数为2.5×10-5.

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(2)向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4.
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准.称取所制备的CuCl样品0.2500g置于一定量的0.5mol/LFeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol/L的Ce(SO4)2溶液滴定,到达滴定终点时消耗Ce(SO4)2溶液24.60mL.有关的化学反应为:Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+,通过计算说明该CuCl样品符合(填“符合”或“不符合”)国家标准.
(4)25℃时,Ksp[Fe(OH]3]=4.0×10-38.Fe3+发生水解反应Fe3++3H2O?Fe(OH)3+3H+,该反应的平衡常数为2.5×10-5.
3.已知 HF 酸性比 HCN 的酸性强.现有物质的量浓度和体积均相同的 NaF 和 NaCN 两种溶液,已知前者溶液中的离子数目为 n1,后者溶液中离子数目为 n2,下列关系正确的是( )
| A. | n1>n2 | B. | n1=n2 | C. | n2>n1 | D. | c(F-)<c(CN-) |
10.25℃时,等体积等浓度的NaHCO3和Na2CO3溶液中,下列判断错误的是( )
| A. | 均存在电离平衡 | B. | 阴离子数目前者大于后者 | ||
| C. | c(OH-)前者小于后者 | D. | 存在的粒子种类相同 |
20.“分类”是一种思想方法,在化学发展中起到了重要的作用.下列说法正确的是( )
| A. | Na2O和Na2O2均能与H2O反应生成NaOH,故二者都是碱性氧化物 | |
| B. | 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 | |
| C. | 根据水溶液能否导电将化合物分为电解质和非电解质 | |
| D. | 碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物 |
7.根据氢原子和氟原子的核外电子排布,对F2和HF分子中形成的共价键描述正确的是( )
| A. | 两者都为s-s σ 键 | B. | 两者都为p-p σ 键 | ||
| C. | 前者为p-p σ 键,后者为s-p σ 键 | D. | 前者为s-s σ 键,后者为s-p σ 键 |
4.下列物质属于脂肪烃的是( )
| A. |  | B. |  | C. |  | D. |  |
10.铁屑溶于过量的盐酸后,再加入下列物质,会有三价铁生成的是( )
| A. | 稀硫酸 | B. | 硫化钠 | C. | 硝酸锌 | D. | 氯化钙 |