题目内容
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
(1)称量样品所用的仪器为_____(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是_______ 。
(2)装置a和c的作用分别是____和____(填标号)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)通过计算可知,该黄铜矿的纯度为________。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____(填序号)。
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有_____________________________________________。
(15分)(1)电子天平(2分),使原料充分反应、加快反应速率(2分)。
(2)b、d和e (各1分,共3分)
(3)使反应生成的SO2全部进入d装置中,使结果精确(2分)。
(4)80%(2分)
(5)②(2分)。
(6) 空气中的CO2与Ba(OH)2反应生成BaCO3沉淀;BaSO3被氧化成BaSO4(合理答案均可)(2分)
解析试题分析:(1)托盘天平的精确度为 0.1g,故只有电子天平才能称取1.150g样品;研细的目的是增大固体的表面积,使原料充分反应、加快反应速率;(2)浓硫酸能除去空气中的水蒸气,且洗气瓶有利于观察空气流速;灼热铜网的目的是除去反应后多余的氧气;(3)反应结束后,仍需通入一段时间的空气,其目的是使反应生成的SO2全部进入d装置中,使结果精确;(4)由c?V可知n(I2)=0.05mol/L×20.00×10—3L,由I2+SO2+2H2O=4H++2I—+SO42—可知n(SO2)=n(I2)=0.05mol/L×20.00×10—3L,则总的n(SO2)=0.05mol/L×20.00×10—3L÷1/10,由CuFeS2~2SO2可知,n(CuFeS2)=0.05mol/L×20.00×10—3L÷1/10÷2,由n?M可知m(CuFeS2)=0.05mol/L×20.00×10—3L÷1/10÷2×184g/mol,则其纯度为0.05mol/L×20.00×10—3L÷1/10÷2×184g/mol÷1.150g×100%=80%;(5)SO2不能与BaCl2反应,故①错误;SO2与Ba(NO3)2溶液反应,生成白色的硫酸钡沉淀,过滤、干燥、称取沉淀的质量,可以测定样品的纯度,故②正确;SO2不能与NaHSO3溶液反应,故③错误;(6)空气中的CO2与Ba(OH)2反应生成BaCO3沉淀,BaSO3被氧化成BaSO4,这些因素都可能导致误差。
考点:考查仪器的使用、影响化学反应速率的因素、混合物的分离和提纯、测定样品的纯度、实验目的、误差分析等相关知识。

富马酸亚铁(分子式为C4H2O4Fe,结构简式为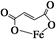 )是一种限量使用的铁强化剂。
)是一种限量使用的铁强化剂。
(1)下图为实验室模拟工业制取富马酸亚铁的流程图: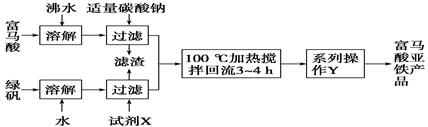
①根据题意,请你写出富马酸的结构简式:________________________。
②绿矾(FeSO4·7H2O)在保存过程中形成的杂质主要有________(填化学式)。
③操作Y包括________、冷却结晶、过滤、洗涤、干燥等。
④判断操作Y中“洗涤”富马酸亚铁产品表明已洗净的实验方法是___________。
(2)设计一个实验方案,证明所得富马酸亚铁产品属于亚铁盐(可供选用的试剂有KSCN溶液、H2O2溶液、稀硫酸。)。填写下表相应空格:
| 步骤 | 实验操作与现象 |
| ① | 取富马酸亚铁产品1.5 g,加入稀硫酸25 mL,用水稀释至50 mL,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液 |
| ② | |
| ③ | |
海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是________(填序号)
| A.Cl2 | B.淡水 | C.烧碱 | D.食盐 |
(3)下图是从海水中提取镁的简单流程。

①工业上常用于沉淀Mg2+的试剂A是________,
 转化为MgCl2的离子方程式是________________________________。
转化为MgCl2的离子方程式是________________________________。②由无水MgCl2制取Mg的化学方程式是________________________。
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧海带至灰烬时所用的主要仪器名称是________________。
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式____________________________。
反应结束后,再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈________色。
某化学兴趣小组同学在馓“证明海带中存在碘元素”的实验时,对课本上的描述:“海带灼烧后的灰烬中碘元素以I-形式存在”产生了疑问。久置KI固体被氧化变质,呈浅黄色(有I2),KI固体直接加热时,为什么不被氧化呢?因此,小组同学针对I-被氧化条件除了氧气之外还需要什么条件进行了实验探究。
【提出假设】根据久置KI固体会被氧化而变质,结合空气的成分,首先排除 和稀有气体的影响。然后对KI变质条件提出合理假设:
假设一:需要H2O的参与;
假设二:需要CO2的参与;
假设三: 。
【实验验证】
(1)为了验证假设二,小组同学设计了以下实验方案;取10mLKI溶液(浓度较大)于5支试管中,向试管中通入CO2气体或者滴加盐酸。一段时间后对比试管中的颜色深浅,之后向试管中滴入淀粉溶液,再次对比试管中的颜色深浅,具体实验现象见下表:
| 试管序号 | 1 | 2 | 3 | 4 | 5 |
| 通入CO2时间/min | 0 | 1 | 5 | | |
| 滴加盐酸/滴 | 0 | | | 3 | 6 |
| 溶液中颜色对比 | 无色 | 浅黄色→黄色(依次加深) | |||
| 滴加淀粉溶液后的颜色对比 | 无色 | 浅蓝色→蓝色(依次加深) | |||
小组同学通过实验现象深入思考了CO2在反应过程中的作用,得出结论:CO2气体同盐酸一样在KI被氧化的过程中提供 环境。
写出此实验中CO2与KI反应的化学方程式 。
(2)为了验证I-被氧化是否必须要有H2O的参与,小组同学设计了以下实验验证:
| 实验步骤 | 预期现象和结论 |
| ①取一份纯净的KI固体,分成两等份; | |
| ②一份加入到装有 的集气瓶A中; 一份加入到装有 的集气瓶A中; ③几天后观察。 | |
【交流提高】
由于空气中CO2和水蒸气的含量很低,导致在加热KI的过程中这两种气体很容易被“驱散”,不能很好地与KI接触,KI自然就不能被氧化。长时间保存碘化钾需要避光、 。



 2CuSO4+2H2O ) ,于是他提出了另一套方案:
2CuSO4+2H2O ) ,于是他提出了另一套方案:

