题目内容
海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是________(填序号)
| A.Cl2 | B.淡水 | C.烧碱 | D.食盐 |
(3)下图是从海水中提取镁的简单流程。

①工业上常用于沉淀Mg2+的试剂A是________,
 转化为MgCl2的离子方程式是________________________________。
转化为MgCl2的离子方程式是________________________________。②由无水MgCl2制取Mg的化学方程式是________________________。
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧海带至灰烬时所用的主要仪器名称是________________。
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式____________________________。
反应结束后,再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈________色。
(1)BD(2)Cl2 + 2Br- = 2Cl- + Br2
(3)①石灰乳或氧化钙(答出可溶 性碱给分) Mg(OH)2 + 2H+ = Mg2+ + 2H2O
②MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
(4)①坩埚 ②2I- + H2O2 + 2H+ = I2 + 2H2O ③紫
解析试题分析:(1)海水蒸发可以得到淡水,并且可析出氯化钠,均为物理变化。
(2)Cl2 + 2Br- = 2Cl- + Br2
(3)可用可溶性碱与镁离子反应生成 Mg(OH)2 沉淀。Mg(OH)2 + 2H+ = Mg2+ + 2H2O MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
(4)①坩埚 可以直接在酒精灯上加热的仪器有试管、圆底烧瓶、蒸发皿、坩埚。坩埚可以加强热。
②2I- + H2O2 + 2H+ = I2 + 2H2O
③ 紫色,碘被萃取。
考点:考查实验方法的思维,以及常见实验仪器的使用,离子反应方程式书写等。

通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收
K2Cr2O7。实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收与再利用工艺如下: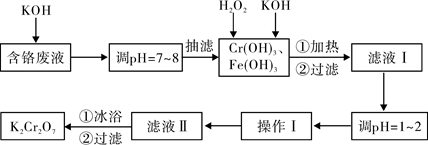
已知:①Cr(OH)3+OH-=CrO2-+2H2O;
②2CrO2-+3H2O2+2OH-=2CrO42-+4H2O;
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。
(1)实验中所用KOH浓度为6 mol·L-1,现用KOH固体配制250mL 6 mol·L-1 的KOH溶液,除烧杯、玻璃棒外,还必需用到的玻璃仪器有 。
(2)由于含铬废液中含有少量的K2Cr2O7,抽滤时可用 代替布氏漏斗;抽滤过程
中要及时观察吸滤瓶内液面高度,当快达到支管口位置时应进行的操作为 。
(3)滤液Ⅰ酸化前,进行加热的目的是 。冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是 。
(4)下表是相关物质的溶解度数据:
| 物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 | 56.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 | 24.1 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 | 102.0 |
| KNO3 | 13.9 | 31.6 | 61.3 | 106 | 167 | 246.0 |
根据溶解度数据,操作Ⅰ具体操作步骤为① 、② 。
(5)称取产品重铬酸钾试样2.000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2 mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①若实验中共用去Na2S2O3标准溶液30.00mL,所得产品的中重铬酸钾的纯度为 (设整个过程中其它杂质不参与反应)。
②若滴定管在使用前未用Na2S2O3标准溶液润洗,测得的重铬酸钾的纯度将: (填“偏高”、“偏低”或“不变”)。
下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: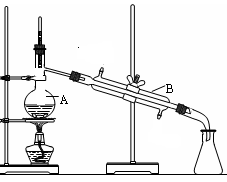
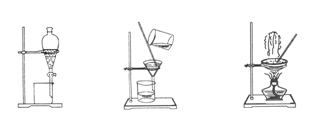
图1 图2 图3 图4
(1)装置图1中A的名称是________,B的名称是 。A 中一般要加入碎瓷片,其作用是 。装置图4中盛溶液的仪器名称是 。
(2)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: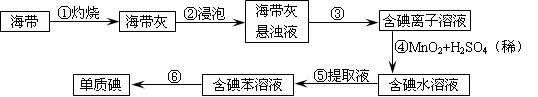
1)灼烧海带时,除需要三脚架外,还需要用到的实验仪器是__________(从下列仪器中选出所需仪器,用标号字母填写在空白处);
| A.烧杯 | B.坩埚 | C.表面皿 | D.泥三角 E.酒精灯 F.干燥器 |
选择上述装置图 (填图的序号)。步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是________,选择上述装置图 (填图的序号)
S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:
① CS2+3Cl2 CCl4+S2Cl2;② 2S+Cl2
CCl4+S2Cl2;② 2S+Cl2 S2Cl2。
S2Cl2。
已知S2Cl2中硫元素显+1价,电子式: ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
实验室利用下列装置制备S2Cl2(部分夹持仪器已略去):

回答下列问题:
(1)装置B、C中玻璃容器的名称: ;反应原理(填写数字序号): 。
(2)实验中盐酸试剂通常采用36.5%的浓溶液,不用稀盐酸的理由是 。
(3)D中冷凝管起到导气和冷凝双重作用,其冷却水流动方向与热气流流动方向相同(见图)。这种冷却方式可应用于下列高中化学中 实验。
A.石油分馏 B.制取溴苯 C.制取乙酸乙酯 D.制备阿司匹林
(4)B装置中盛放的是 ,反应结束后从锥形瓶内混合物中分离出产品的方法是 ,D中采用热水浴加热的原因是 。
(5)A部分仪器装配时,放好铁架台后,应先固定 (填仪器名称),整套装置装配完毕后,应先进行 再添加试剂。实验完毕,A中不再产生氯气时,可拆除装置。拆除时,最先的操作应当是 。
(6)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因可用化学方程式表示为 。实验完毕,当把剩余浓盐酸倒入E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是: (用离子方程式表示)。
某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质离子。某小组在实验室中用浸出-萃取法制备硫酸铜:
(1)操作I为_______。操作II用到的玻璃仪器有烧杯_______
(2)操作II、操作III的主要目的是_______、富集铜元素。
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液。多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4。
已知Cu(OH)2、Cu2(OH)2CO3、Cu4((OH)6SO4均难溶于水,可溶于酸;分解温度依次为 80℃、200℃、300℃。
设计实验检验悬浊液成分,完成表中内容。
限选试剂:2mol?L-1HCl、1 mol?L-1H2SO4、0.1 mol?L-1NaOH、0.1 mol?L-1 BaCl2、蒸馏水。仪器和用品自选。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,_______________________________________________________________ | 说明悬浊液中混__________________________________________,有Cu4( OH)6SO4。 |
| 步骤2:另取少量悬浊液于试管中,____________________________ | ______________, 说明悬浊液中混有Cu( OH) 2。 |
(4)上述实验需要100mL 0.5 mol?L-1的CuSO4溶液,配制时需称取_______gCuSO4?5H2O (化学式量:250)。
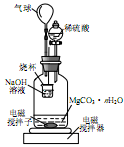
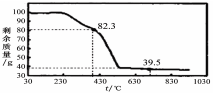



 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题: