题目内容
某同学设计了以下流程检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质。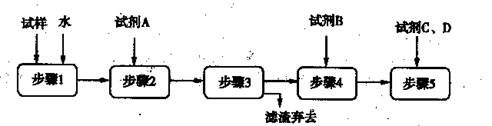
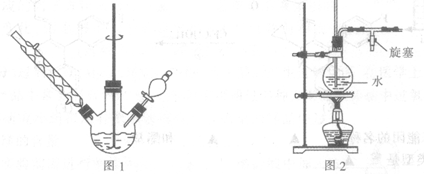
(1)步骤1所需玻璃仪器是 ;步骤3的操作名称是 。
(2)对检验碳酸钠粉末中可能含有的杂质提出合理假设:
假设1:只含有氯化钠
假设2:只含有 。
假设3:氯化钠和氢氧化钠都存在
(3)设计实验方案,进行试验。
限选以下试剂:氯化钡溶液、硝酸钡溶液、酚酞试液、稀硝酸、稀盐酸、稀硫酸、硝酸银溶液。回答下列问题:
①加入过量试剂A的名称是 。
②填写下表:
| 实验步骤 | 预期现象和结论 |
| 步骤4: | |
| 步骤5: | |
(1)(3分)烧杯、玻璃棒(2分);过滤(1分)
(2)(1分)氢氧化钠
(3)(10分)① 硝酸钡溶液(2分)
②实验步骤 预期现象和结论 步骤4:
取少量滤液于试管,往其中滴加2~3滴酚酞试液。(2分)如果酚酞变红,假设2或假设3成立。
如果酚酞不变红,假设1成立.。(2分)步骤5:
用试管取少量滤液,往其中滴加足量的稀硝酸至溶液呈酸性,再滴加硝酸银溶液。(2分)若没有白色沉淀生成,则说明假设2成立。
若没有白色沉淀生成,则说明假设1或假设3成立;结合步骤4如果酚酞变红,假设3成立。(2分)
解析试题分析:(1)步骤1为溶解试样,用到的仪器有烧杯和玻璃杯;通过步骤3可得到滤渣,所以步骤3为过滤。
(2)因为假设3:氯化钠和氢氧化钠都存在,假设1:只含有氯化钠,另一种可能为假设2为:只含有氢氧化钠。
(3)①根据题目所给信息分析实验原理,先用过量试剂A除去碳酸钠,然后取滤液检验是否含有氢氧化钠和氯化钠,试剂A不能影响氢氧化钠和氯化钠的检验,应为硝酸钡溶液。
②检验氢氧化钠,利用酸碱性,用酚酞检验;检验氯化钠用稀硝酸和硝酸银。
考点: 本题考查实验基本仪器、基本操作和实验方案的设计。

下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
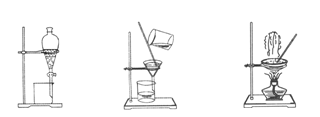
图1 图2 图3 图4
(1)装置图1中A的名称是________,B的名称是 。A 中一般要加入碎瓷片,其作用是 。装置图4中盛溶液的仪器名称是 。
(2)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
1)灼烧海带时,除需要三脚架外,还需要用到的实验仪器是__________(从下列仪器中选出所需仪器,用标号字母填写在空白处);
| A.烧杯 | B.坩埚 | C.表面皿 | D.泥三角 E.酒精灯 F.干燥器 |
选择上述装置图 (填图的序号)。步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是________,选择上述装置图 (填图的序号)
S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:
① CS2+3Cl2 CCl4+S2Cl2;② 2S+Cl2
CCl4+S2Cl2;② 2S+Cl2 S2Cl2。
S2Cl2。
已知S2Cl2中硫元素显+1价,电子式: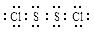 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
实验室利用下列装置制备S2Cl2(部分夹持仪器已略去):
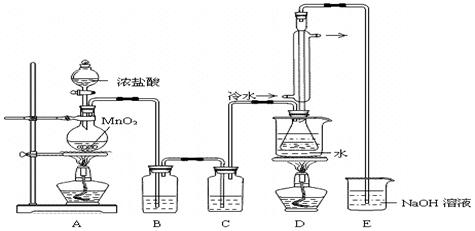
回答下列问题:
(1)装置B、C中玻璃容器的名称: ;反应原理(填写数字序号): 。
(2)实验中盐酸试剂通常采用36.5%的浓溶液,不用稀盐酸的理由是 。
(3)D中冷凝管起到导气和冷凝双重作用,其冷却水流动方向与热气流流动方向相同(见图)。这种冷却方式可应用于下列高中化学中 实验。
A.石油分馏 B.制取溴苯 C.制取乙酸乙酯 D.制备阿司匹林
(4)B装置中盛放的是 ,反应结束后从锥形瓶内混合物中分离出产品的方法是 ,D中采用热水浴加热的原因是 。
(5)A部分仪器装配时,放好铁架台后,应先固定 (填仪器名称),整套装置装配完毕后,应先进行 再添加试剂。实验完毕,A中不再产生氯气时,可拆除装置。拆除时,最先的操作应当是 。
(6)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因可用化学方程式表示为 。实验完毕,当把剩余浓盐酸倒入E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是: (用离子方程式表示)。
某校化学小组的同学进行以碳棒为电极电解氯化铜溶液时发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出。为探究阴极碳棒上的产物,设计了如下过程:
Ⅰ、有关资料
铜的化合物颜色性质如下:
| 物质 | 颜色、性质 | 物质 | 颜色、性质 |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
| 氧化亚铜(CuO) | 红色固体不溶于水 | 氯化铜(CuCl2) | 溶液呈绿色,稀溶液呈蓝色 |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
(1)提出假设:①红色物质一定有铜,还可能有Cu2O;②白色物质为铜的化合物,其化学式可能为CuCl
(2)实验验证:取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物

实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色。
①碳棒上的红色物质是否有Cu2O (填“是”或“否”),理由是
;②在c装置后将气体通入 中,若出现白色沉淀,可说明提出假设②中的白色物质一定存在;③写出装置b中发生反应的化学方程式:
。
(3)问题讨论:
①电解CuCl2溶液后的阴极上发生的反应为:Cu2++2e-=Cu和 ;②用石墨电极电解饱和硫酸铜溶液,观察阴极碳棒表面出现的现象红色物质附着,无白色物质,加入 后继续电解,出现白色物质。
漂白粉是一种常用的消毒剂。
(1)工业上生产漂白粉反应的化学方程式为:________________ __,漂白粉的有效成分为 。
(2)某探究小组从市场上购买了一袋包装破损的漂白粉,对该漂白粉的成分进行探究。根据下列试剂,设计实验方案,进行实验。请在答题卡上完成实验报告。
限选试剂:2mol·L-1NaOH溶液、2mol·L-1HCl溶液、2mol·L-1HNO3溶液、0.5mol·L-1BaCl2溶液、0.01mol·L-1AgNO3溶液、澄清石灰水、石蕊试液、酚酞试液、蒸馏水。
| 实验步骤 | 预期现象与结论 |
| 步骤1:取适量漂白粉溶于足量蒸馏水,充分搅拌,静置,过滤,得沉淀和滤液。 | |
| 步骤2:向沉淀加入适量2mol·L-1HCl溶液,将产生的气体通入 | 现象: 结论: |
| 步骤3:取滤液分装A、B两支试管。向A试管, | 现象:溶液先变红色,然后褪色。 结论: |
| 步骤4:向B试管, | 现象:产生白色沉淀。 结论: |
(3)探究小组为测定漂白粉中Ca(ClO)2的含量:称取漂白粉bg加水溶解后配制成100mL溶液,准确量取25.00mL于锥形瓶并加入足量盐酸和KI溶液,充分反应后,溶液中的游离碘用0.1000mol/L的Na2S2O3溶液滴定,滴定2次,平均消耗Na2S2O3溶液20.00mL。则该漂白粉中Ca(ClO)2的质量分数为_____________ _。(只列算式,不做运算,已知:Mr[Ca(ClO)2]="143" ;Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,2Na2S2O3+I2=Na2S4O6+2NaI)
某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质离子。某小组在实验室中用浸出-萃取法制备硫酸铜:
(1)操作I为_______。操作II用到的玻璃仪器有烧杯_______
(2)操作II、操作III的主要目的是_______、富集铜元素。
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液。多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4。
已知Cu(OH)2、Cu2(OH)2CO3、Cu4((OH)6SO4均难溶于水,可溶于酸;分解温度依次为 80℃、200℃、300℃。
设计实验检验悬浊液成分,完成表中内容。
限选试剂:2mol?L-1HCl、1 mol?L-1H2SO4、0.1 mol?L-1NaOH、0.1 mol?L-1 BaCl2、蒸馏水。仪器和用品自选。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,_______________________________________________________________ | 说明悬浊液中混__________________________________________,有Cu4( OH)6SO4。 |
| 步骤2:另取少量悬浊液于试管中,____________________________ | ______________, 说明悬浊液中混有Cu( OH) 2。 |
(4)上述实验需要100mL 0.5 mol?L-1的CuSO4溶液,配制时需称取_______gCuSO4?5H2O (化学式量:250)。
下列气体只能用排水集气法收集的是
| A.NO | B.NO2 | C.SO2 | D.NH3 |

 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题: