题目内容
12.下列关于钠的氧化物的说法正确的是( )| A. | Na2O2是白色固体,与冷水作用放出氧气,生成氢氧化钠 | |
| B. | 在Na2O2与CO2的反应中,氧化剂是Na2O2,还原剂是CO2 | |
| C. | Na2O不稳定,能继续被氧化,生成Na2O2 | |
| D. | Na2O2能与水反应,生成NaOH,所以Na2O2是碱性氧化物 |
分析 A.Na2O2是浅黄色固体,不是白色固体;
B.Na2O2与CO2反应时,Na2O2既是氧化剂又是还原剂,CO2在反应中元素的化合价未改变;
C.由于钠在常温下与氧气反应生成氧化钠,在加热情况下生成过氧化钠,可知氧化钠易被氧化为过氧化钠;
D.碱性氧化物是指能与酸反应生成盐和水的氧化物,并不是指能与水反应生成碱的氧化物.另外,按Na2O2与CO2、H2O反应的规律,可推知Na2O2与酸反应时,除生成盐、水外还应有O2生成,Na2O2不是碱性氧化物
解答 解:A.Na2O2是浅黄色固体,不是白色固体,故A错误;
B.Na2O2与CO2反应时,过氧化钠中氧元素化合价-1价变化为-2价和0价,Na2O2既是氧化剂又是还原剂,CO2在反应中元素的化合价未改变,故B错误;
C.因2Na2O+O2═Na2O2,则Na2O能被氧化成Na2O2,Na2O不稳定,能继续被氧化,生成Na2O2 ,故C正确;
D.碱性氧化物是指能与酸反应生成盐和水的氧化物,并不是指能与水反应生成碱的氧化物.另外,按Na2O2与CO2、H2O反应的规律,可推知Na2O2与酸反应时,除生成盐、水外还应有O2生成,Na2O2不是碱性氧化物,故D错误;
故选C.
点评 本题考查了钠及其化合物性质的分析,主要是物质物理性质、化学性质的理解应用,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
2.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 铝和盐酸反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 氢气还原氧化铜 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
3.如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定).
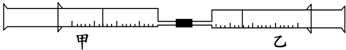
试回答下列问题:
(1)实验1中,沉淀最终变为红褐色色,写出生成白色沉淀的离子方程式:Fe2++2NH3.H2O=Fe(OH)2↓+2NH4+.
(2)实验2中,甲中最后剩余的无色气体是NO,写出NO2与H2O反应的化学方程式3NO2+H2O═2HNO3+NO.
(3)实验3中,已知:3Cl2+2NH3═N2+6HCl.甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为黄绿色变为无色,最后针筒内剩余气体的体积约为5mL.

| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒 的现象 |
| 1 | 10mL FeSO4溶液 | 10mL NH3 | 生成白色沉淀,后变色 |
| 2 | 30mL NO2 | 10mL H2O(l) | 剩无色气体 |
| 3 | 15mL Cl2 | 40mL NH3 |
(1)实验1中,沉淀最终变为红褐色色,写出生成白色沉淀的离子方程式:Fe2++2NH3.H2O=Fe(OH)2↓+2NH4+.
(2)实验2中,甲中最后剩余的无色气体是NO,写出NO2与H2O反应的化学方程式3NO2+H2O═2HNO3+NO.
(3)实验3中,已知:3Cl2+2NH3═N2+6HCl.甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为黄绿色变为无色,最后针筒内剩余气体的体积约为5mL.
20.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 L 0.1mol•L-1的氨水含有0.1NA个OH- | |
| B. | 常温常压下,22.4 LCCl4含有NA个CCl4分子 | |
| C. | 1mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| D. | 常温下,23g N2O4和NO2的混合气体中,含有NA个氧原子 |
7.分子式为C4H802,且一定条件下能与NaOH溶液反应,其可能结构有(不含立体异构)( )
| A. | 2种 | B. | 4种 | C. | 6种 | D. | 8种 |
17.下列各组物质中,只用一种试剂就能区别的是( )
①FeCl2、Al(NO3)3、MgSO4、NH4NO3四种溶液
②MnO2、FeS、CuO、C四种黑色固体
③盐酸、Na2SO4、NaOH三种溶液
④NaCl、AlCl3、Ba(OH)2、HCl四种溶液.
①FeCl2、Al(NO3)3、MgSO4、NH4NO3四种溶液
②MnO2、FeS、CuO、C四种黑色固体
③盐酸、Na2SO4、NaOH三种溶液
④NaCl、AlCl3、Ba(OH)2、HCl四种溶液.
| A. | ①③ | B. | ①②④ | C. | ①②③ | D. | 全部 |
4.下列说法错误的是( )
| A. | 催化剂可以改变化学反应速率 | |
| B. | 食物放在冰箱中会减慢食物变质的速率 | |
| C. | 2molSO2与 1molO2一定能生成2molSO3 | |
| D. | 锌与稀硫酸反应时,加入少量铜粉能加快反应 |
1.常温下,下列各组离子一定能大量共存的是( )
| A. | 滴加石蕊显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| B. | [H+]=10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- | |
| C. | [OH-]/[H+]=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | 由水电离的[H+]=1.0×10-13 mol•L-1的溶液中:K+、NH4+、AlO2-、HCO3- |
2.25℃时,水中存在平衡:H2O?H++OH-△H>0,下列叙述正确的是( )
| A. | 加入稀氨水,平衡逆向移动,c(OH-)降低,Kw不变 | |
| B. | 加入少量固体CuSO4,c (H+)增大,Kw不变 | |
| C. | 加入少量固体CH3COONa,平衡逆向移动,c (H+)降低,Kw不变 | |
| D. | 加热到90℃,Kw增大,溶液仍呈中性,pH不变 |