题目内容
 已知硫酸工业生产过程中涉及的化学反应有:
已知硫酸工业生产过程中涉及的化学反应有:Ⅰ.S(s)+O2(g)=SO2(g)△H=-298kJ/mol
Ⅱ.2SO2(g)+O2(g)?2SO3(g)△H=-196kJ/mol
Ⅲ.SO3(g)+H2O(1)=H2SO4(1)△H=-130.3kJ/mol
(1)根据反应I可知,lmol硫和lmol O2具有的能量总和
(2)由以上反应可得:S(s)+2H2SO4(1)=2H2O(1)+3SO2(g)△H=
(3)300℃时,SO2和O2在2L的恒容密闭容器中发生上述反应II,3min达到化学平衡.
①反应达到平衡时,下列描述一定正确的是
a.容器内分子数不再发生变化
b.v(SO2)=v(SO3)
c.SO3不再分解
d.容器内气体密度不再发生变化
②反应达到平衡后,若改变条件使该反应的平衡常数K值变大,则在平衡移动过程中正反应速率
a.一直增大 b.一直减小 c.先增大后减小 d.先减小后增大
③反应达平衡后,在第5min时向容器中再通入2molSO2和2mol SO3,化学平衡向
考点:用盖斯定律进行有关反应热的计算,化学平衡的影响因素,化学平衡状态的判断,物质的量或浓度随时间的变化曲线
专题:化学反应中的能量变化,化学平衡专题
分析:(1)△H=E(生成物的能量和)-E(反应物的能量和);
(2)利用盖斯定律计算反应热;
(3)①化学平衡状态的判断
②化学平衡常数的求算
③勒夏特列原理的应用
注意:1、化学平衡常数越大说明反应向正向反应的程度越大.
2、平衡常数只受温度影响
3、影响平衡移动的因素只有3个,温度、浓度、压强
(2)利用盖斯定律计算反应热;
(3)①化学平衡状态的判断
②化学平衡常数的求算
③勒夏特列原理的应用
注意:1、化学平衡常数越大说明反应向正向反应的程度越大.
2、平衡常数只受温度影响
3、影响平衡移动的因素只有3个,温度、浓度、压强
解答:
解:(1)△H=E(生成物的能量和)-E(反应物的能量和)=-298kJ/mol,说明反应物能量高.
故答案为:大于;
(2)反应ⅠS(s)+O2(g)=SO2(g)△H=-298kJ/mol
反应Ⅱ2SO2(g)+O2(g)?2SO3(g)△H=-196kJ/mol
反应Ⅲ.SO3(g)+H2O(1)=H2SO4(1)△H=-130.3kJ/mol
Ⅰ-Ⅱ得:2SO3(g)+S(s)=3SO2(g)△H=-102kJ/molⅣ
Ⅳ-Ⅲ×2:S(s)+2H2SO4(1)=2H2O(1)+3SO2(g)△H═+158.6kJ/mol
故答案为:△H=+158.6;
(3)①可逆反应达到化学平衡后,各物质的浓度、物质的量、分子个数、质量、密度、速率等等都不再变化,本题中:a、c属于不变,b属于速率之比等于系数比,无论平衡与否都是.
故答案为:abd;
②平衡常数只受温度影响,要使该反应的平衡常数K值变大,由于该反应是放热反应,故只能是降温,降温会使化学反应速率减慢,并且平衡向正反应方向移动.
故答案为:b;
③增加2molSO2和2molSO3,唯独没有增加O2的量,可理解为没加SO2和SO3只减少了O2,所以平衡向逆向移动.
第二问注意纵坐标是浓度,不是物质的量,体积是2L,SO2的浓度变为2mol+
=3mol/L并且不断增大,
SO3的浓度变为1mol/L+
=2mol/L并且不断减少,O2的浓度增加.
5~10min时间段各物质浓度的变化趋势曲线如图所示:
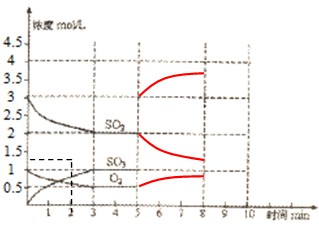
故答案为:逆;5~10min时间段各物质浓度的变化趋势曲线为:

故答案为:大于;
(2)反应ⅠS(s)+O2(g)=SO2(g)△H=-298kJ/mol
反应Ⅱ2SO2(g)+O2(g)?2SO3(g)△H=-196kJ/mol
反应Ⅲ.SO3(g)+H2O(1)=H2SO4(1)△H=-130.3kJ/mol
Ⅰ-Ⅱ得:2SO3(g)+S(s)=3SO2(g)△H=-102kJ/molⅣ
Ⅳ-Ⅲ×2:S(s)+2H2SO4(1)=2H2O(1)+3SO2(g)△H═+158.6kJ/mol
故答案为:△H=+158.6;
(3)①可逆反应达到化学平衡后,各物质的浓度、物质的量、分子个数、质量、密度、速率等等都不再变化,本题中:a、c属于不变,b属于速率之比等于系数比,无论平衡与否都是.
故答案为:abd;
②平衡常数只受温度影响,要使该反应的平衡常数K值变大,由于该反应是放热反应,故只能是降温,降温会使化学反应速率减慢,并且平衡向正反应方向移动.
故答案为:b;
③增加2molSO2和2molSO3,唯独没有增加O2的量,可理解为没加SO2和SO3只减少了O2,所以平衡向逆向移动.
第二问注意纵坐标是浓度,不是物质的量,体积是2L,SO2的浓度变为2mol+
| 2mol |
| 2L |
SO3的浓度变为1mol/L+
| 2mol |
| 2L |
5~10min时间段各物质浓度的变化趋势曲线如图所示:

故答案为:逆;5~10min时间段各物质浓度的变化趋势曲线为:

点评:考查范围较广,问题相对简单,适合现在的高考.考察学生对基础知识的掌握及灵活运用能力.特别是(3)的②,出的很好.

练习册系列答案
相关题目
钠在空气中发生变化的过程为( )
| A、Na→Na2O2→NaOH→Na2CO3?10H2O→Na2CO3 |
| B、Na→Na2O→NaOH→Na2CO3?10H2O→Na2CO3 |
| C、Na→Na2O2→NaOH→Na2CO3?10H2O→HaHCO3 |
| D、Na→Na2O→NaOH→Na2CO3?10H2O→NaHCO3 |
下列存放物质的方法中错误的是( )
| A、用棕色细口试剂瓶存放氯水 |
| B、NaOH溶液盛装在带橡皮塞的试剂瓶中 |
| C、漂白粉长期放置于敞口烧杯中 |
| D、FeSO4溶液存放在含少量铁粉的试剂瓶中 |
 Ⅰ.( 1)在一个体积为2L的密闭容器中充入6mol SO2和3mol O2,进行下列反应2SO2(g)+O2(g)?2SO3(g),保持温度不变,2min后达到平衡,测得混合气体中O2的体积分数为25%,用SO2浓度变化来表示的化学反应速率为
Ⅰ.( 1)在一个体积为2L的密闭容器中充入6mol SO2和3mol O2,进行下列反应2SO2(g)+O2(g)?2SO3(g),保持温度不变,2min后达到平衡,测得混合气体中O2的体积分数为25%,用SO2浓度变化来表示的化学反应速率为