题目内容
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用.其实验方案如下:
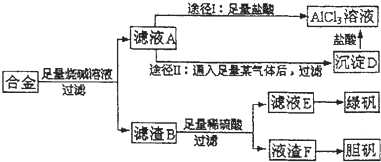
试回答下列问题:
(1)写出合金溶于足量烧碱溶液时相关反应的离子方程式 ;
(2)由滤液A制AlCl3溶液有途径Ⅰ和途径Ⅱ两种,你认为哪种途径比较合理,说明理由 .
(3)从滤液E中得到绿矾的实验操作是 .
(4)按环保要求,写出用滤渣F制备胆矾的各步反应的化学方程式 .
(5)有同学提出可将方案中最初溶解合金的烧碱改为盐酸,重新设计方案,也能得到三种物质,你认为后者的方案是否更合理,理由是 .
(6)若上述方案所用的稀硫酸溶质质量分数为36.8%,那么100mL98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸 g.

试回答下列问题:
(1)写出合金溶于足量烧碱溶液时相关反应的离子方程式
(2)由滤液A制AlCl3溶液有途径Ⅰ和途径Ⅱ两种,你认为哪种途径比较合理,说明理由
(3)从滤液E中得到绿矾的实验操作是
(4)按环保要求,写出用滤渣F制备胆矾的各步反应的化学方程式
(5)有同学提出可将方案中最初溶解合金的烧碱改为盐酸,重新设计方案,也能得到三种物质,你认为后者的方案是否更合理,理由是
(6)若上述方案所用的稀硫酸溶质质量分数为36.8%,那么100mL98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:流程分析:铝、铁、铜的合金中加入足量烧碱溶液,只有铝与其反应而溶解,过滤后得滤渣B的成分为铁和铜,滤液A为偏铝酸钠溶液;滤液A生成氯化铝溶液的途径Ⅰ发生反应:NaAlO2+4HCl=AlCl3↓+NaCl+2H2O;而途径Ⅱ通入足量的二氧化碳反应后过滤能得到纯净的氢氧化铝,氢氧化铝与盐酸反应能制得AlCl3溶液;滤渣B中只有铁和稀硫酸反应,反应后经过滤得滤渣为铜,再由铜制取胆矾,滤液为硫酸亚铁溶液,然后由溶液制取晶体.
(1)铝与碱反应生成偏铝酸钠和氢气;
(2)途径Ⅰ会引入氯化钠杂质;而途径Ⅱ能制得纯净的AlCl3溶液;
(3)由溶液制取晶体,需经过加热浓缩,冷却结晶、过滤洗涤、干燥;
(4)铜和氧气和酸反应生成硫酸铜和水;
(5)将方案中最初溶解合金的烧碱改为盐酸,后者操作步骤多,消耗的试剂量更多,时间长;
(6)根据溶液稀释前后溶质的质量不变.
(1)铝与碱反应生成偏铝酸钠和氢气;
(2)途径Ⅰ会引入氯化钠杂质;而途径Ⅱ能制得纯净的AlCl3溶液;
(3)由溶液制取晶体,需经过加热浓缩,冷却结晶、过滤洗涤、干燥;
(4)铜和氧气和酸反应生成硫酸铜和水;
(5)将方案中最初溶解合金的烧碱改为盐酸,后者操作步骤多,消耗的试剂量更多,时间长;
(6)根据溶液稀释前后溶质的质量不变.
解答:
解:流程分析:铝、铁、铜的合金中加入足量烧碱溶液,只有铝与其反应而溶解,过滤后得滤渣B的成分为铁和铜,滤液A为偏铝酸钠溶液;滤液A生成氯化铝溶液的途径Ⅰ发生反应:NaAlO2+4HCl=AlCl3↓+NaCl+2H2O;而途径Ⅱ通入足量的二氧化碳反应后过滤能得到纯净的氢氧化铝,氢氧化铝与盐酸反应能制得AlCl3溶液;滤渣B中只有铁和稀硫酸反应,反应后经过滤得滤渣为铜,再由铜制取胆矾,滤液为硫酸亚铁溶液,然后由溶液制取晶体.
(1)铝与碱反应生成偏铝酸钠和氢气,化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,则离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)途径Ⅰ发生反应:NaAlO2+4HCl=AlCl3↓+NaCl+2H2O,会引入盐酸,氯化钠杂质;而途径Ⅱ通入足量的二氧化碳后过滤能得到氢氧化铝,与盐酸反应能制得AlCl3溶液;
故答案为:途径Ⅱ比较好,途径I制得的AlCl3溶液中含有大量的NaCl,而途径Ⅱ能制得纯净的AlCl3溶液;
(3)由硫酸亚铁溶液制取晶体,需经过加热浓缩,冷却结晶、过滤洗涤、干燥才可得到,
故答案为:蒸发浓缩,冷却结晶;
(4)铜和氧气和酸反应生成硫酸铜和水:2Cu+2H2SO4+O2=2CuSO4+2H2O,
故答案为:2Cu+2H2SO4+O2=2CuSO4+2H2O;
(5)将方案中最初溶解合金的烧碱改为盐酸,铁、铝与盐酸都反应,应加入过量的氢氧化钠分离二者,消耗的试剂量更多,且操作复杂,不如原实验方案合理,
故答案为:不合理;因为后者操作步骤多,消耗的试剂量更多,时间长;
(6)设能够配制这种硫酸的质量为x
100mL×1.84g/mL×98%=x?36.8%
解得:x=490g
故答案为:490.
(1)铝与碱反应生成偏铝酸钠和氢气,化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,则离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)途径Ⅰ发生反应:NaAlO2+4HCl=AlCl3↓+NaCl+2H2O,会引入盐酸,氯化钠杂质;而途径Ⅱ通入足量的二氧化碳后过滤能得到氢氧化铝,与盐酸反应能制得AlCl3溶液;
故答案为:途径Ⅱ比较好,途径I制得的AlCl3溶液中含有大量的NaCl,而途径Ⅱ能制得纯净的AlCl3溶液;
(3)由硫酸亚铁溶液制取晶体,需经过加热浓缩,冷却结晶、过滤洗涤、干燥才可得到,
故答案为:蒸发浓缩,冷却结晶;
(4)铜和氧气和酸反应生成硫酸铜和水:2Cu+2H2SO4+O2=2CuSO4+2H2O,
故答案为:2Cu+2H2SO4+O2=2CuSO4+2H2O;
(5)将方案中最初溶解合金的烧碱改为盐酸,铁、铝与盐酸都反应,应加入过量的氢氧化钠分离二者,消耗的试剂量更多,且操作复杂,不如原实验方案合理,
故答案为:不合理;因为后者操作步骤多,消耗的试剂量更多,时间长;
(6)设能够配制这种硫酸的质量为x
100mL×1.84g/mL×98%=x?36.8%
解得:x=490g
故答案为:490.
点评:本题主要考查了从工业废料中制取纯净物,注意从框图转化中找出有用信息,利用有关的化学反应进行解答,难度中等.

练习册系列答案
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目
将一定温度下的饱和硝酸钾溶液变为不饱和溶液,可以采取的方法是( )
| A、升温或加水 |
| B、降温或加水 |
| C、升温或蒸发水 |
| D、降温或蒸发水 |
下列离子方程式正确的是( )
| A、氯气通入氢氧化钠溶液制消毒液:Cl2+2OH-=ClO-+Cl-+H2O |
| B、硫酸铜溶液与氢氧化钡溶液混合:SO42-+Ba2+=BaSO4↓ |
| C、碳酸氢钠与稀硫酸:CO32-+2H+=H2O+CO2↑ |
| D、二氧化碳气体通入过量氢氧化钠溶液:OH-+CO22-=HCO3- |



 已知硫酸工业生产过程中涉及的化学反应有:
已知硫酸工业生产过程中涉及的化学反应有: