题目内容
 某校化学兴趣小组的同学用如图装置进行实验,已知分液漏斗、小试管中均盛有水.请回答下列问题:
某校化学兴趣小组的同学用如图装置进行实验,已知分液漏斗、小试管中均盛有水.请回答下列问题:(1)检验该装置气密性的方法是
(2)该小组的同学用铜箔包好一小块金属钠,并将铜箔扎透很多小眼,置于锥形瓶中.打开分液漏斗的活塞滴水,观察到的现象是
(3)重新安装好该套装置后,该小组的同学又将适量过氧化钠粉末置于锥形瓶中.打开分液漏斗的活塞滴加少量的水,观察到的现象是
考点:实验装置综合,钠的化学性质,钠的重要化合物
专题:实验设计题
分析:(1)使装置形成密闭系统,给锥形瓶加热,根据小试管中的现象分析;
(2)Na与水反应生成氢氧化钠和氢气,氢气燃烧生成水,根据检验水的方法分析;
(3)过氧化钠与水反应生成氢氧化钠和氧气,氧气能支持燃烧.
(2)Na与水反应生成氢氧化钠和氢气,氢气燃烧生成水,根据检验水的方法分析;
(3)过氧化钠与水反应生成氢氧化钠和氧气,氧气能支持燃烧.
解答:
解:(1)关闭分液漏斗的活塞使装置形成密闭系统,用热毛巾捂热锥形瓶,锥形瓶中气体受热膨胀,在小试管中会有气泡冒出,冷却后导管中形成一段水柱,则装置气密性良好,否则装置漏气;
故答案为:关闭分液漏斗的活塞,用热毛巾捂热锥形瓶,如果小试管中有气泡冒出,冷却后导管中形成一段水柱,则装置气密性良好,否则装置漏气;
(2)用铜箔包好一小块金属钠,并将铜箔扎透很多小眼,置于锥形瓶中,Na与水接触反应生成氢氧化钠和氢气,反应方程式为:2Na+2H2O=2NaOH+H2↑;氢气燃烧生成水,水与无水硫酸铜结合,使无水硫酸铜变蓝色,则检验氢气的方法为:点燃气体,把产物通入无水硫酸铜,若变蓝色,证明是氢气;
故答案为:铜箔表面有大量气泡冒出;2Na+2H2O=2NaOH+H2↑;点燃气体,把产物通入无水硫酸铜,若变蓝色,证明是氢气;
(3)过氧化钠与水反应生成氢氧化钠和氧气,过氧化钠固体逐渐减少最后消失,同时生成大量的气体,反应的方程式为2Na2O2+2H2O═4NaOH+O2↑;氧气能支持燃烧,能够使带火星的木条复燃,则检验氧气的方法为:用带火星的木条检验,若木条复燃,说明为氧气;
故答案为:过氧化钠粉逐渐减少最后消失,同时产生大量气泡;2Na2O2+2H2O═4NaOH+O2↑;用带火星的木条检验,若木条复燃,说明为氧气.
故答案为:关闭分液漏斗的活塞,用热毛巾捂热锥形瓶,如果小试管中有气泡冒出,冷却后导管中形成一段水柱,则装置气密性良好,否则装置漏气;
(2)用铜箔包好一小块金属钠,并将铜箔扎透很多小眼,置于锥形瓶中,Na与水接触反应生成氢氧化钠和氢气,反应方程式为:2Na+2H2O=2NaOH+H2↑;氢气燃烧生成水,水与无水硫酸铜结合,使无水硫酸铜变蓝色,则检验氢气的方法为:点燃气体,把产物通入无水硫酸铜,若变蓝色,证明是氢气;
故答案为:铜箔表面有大量气泡冒出;2Na+2H2O=2NaOH+H2↑;点燃气体,把产物通入无水硫酸铜,若变蓝色,证明是氢气;
(3)过氧化钠与水反应生成氢氧化钠和氧气,过氧化钠固体逐渐减少最后消失,同时生成大量的气体,反应的方程式为2Na2O2+2H2O═4NaOH+O2↑;氧气能支持燃烧,能够使带火星的木条复燃,则检验氧气的方法为:用带火星的木条检验,若木条复燃,说明为氧气;
故答案为:过氧化钠粉逐渐减少最后消失,同时产生大量气泡;2Na2O2+2H2O═4NaOH+O2↑;用带火星的木条检验,若木条复燃,说明为氧气.
点评:本题考查了钠及钠的化合物的性质的实验、气体的检验,侧重于考查学生的实验探究能力,题目难度中等,注意把握方程式的书写和气体的检验方法.

练习册系列答案
相关题目
将等体积的甲烷与氯气混合于一集气瓶中,加盖后置于光亮处,下列有关此实验的现象和结论叙述不正确的是( )
| A、瓶中气体的黄绿色逐渐变浅 |
| B、瓶内壁有油状液滴形成 |
| C、若日光直射,可能发生爆炸 |
| D、生成物只有CH3Cl、CH2Cl2、CHCl3、CCl4 |
下列关于盖斯定律描述不正确的是( )
| A、化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关 |
| B、盖斯定律遵守能量守恒定律 |
| C、利用盖斯定律可间接计算通过实验难测定的反应的反应热 |
| D、利用盖斯定律可以计算有副反应发生的反应的反应热 |
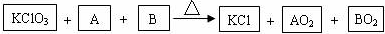
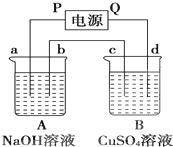 按如图装置实验,A、B两烧杯分别盛放200g10% NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有Cu析出.又测得烧杯A溶液的质量减少4.5g,电极均为石墨电极,试回答:
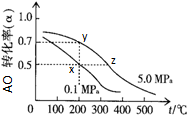
按如图装置实验,A、B两烧杯分别盛放200g10% NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有Cu析出.又测得烧杯A溶液的质量减少4.5g,电极均为石墨电极,试回答: 磷单质及其化合物在工业有广泛应用.
磷单质及其化合物在工业有广泛应用. 用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题:
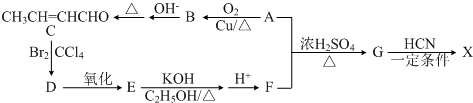
用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题: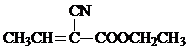 )是合成某种手术用粘合剂的单体,X的合成路线如下:
)是合成某种手术用粘合剂的单体,X的合成路线如下: