题目内容
2.天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.(1)已知:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
工业上可用煤制天然气,生产过程中有多种途径生成CH4.写出CO与H2反应生成CH4和H2O的热化学方程式CO(g)+3H2(g)
 CH4(g)+H2O(g)△H=-203kJ•mol-1.
CH4(g)+H2O(g)△H=-203kJ•mol-1.(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS.一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式2NH4HS+O2=2NH3•H2O+2S↓.
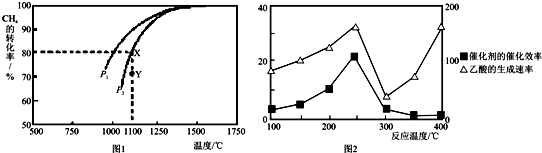
(3)用天然气制取H2的原理为:CO2(g)+CH4(g)?2CO(g)+2H2(g).在密闭容器中通入物质的量浓度均为0.1mol•L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1小于P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)大于v(逆)(填“大于”、“小于”或“等于”). 求Y点对应温度下的该反应的平衡常数K=1.6mol2•L-2.(计算结果保留两位有效数字)
(4)以二氧化钛表面覆盖CuAl2O4 为催化剂,可以将CH4和CO2直接转化成乙酸.
①在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250°C时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强或增大CO2的浓度.
分析 (1)已知:Ⅰ.CO(g)+H2O(g)?H2(g)+CO2(g)△H1=-41kJ•mol-1
Ⅱ.C(s)+2H2(g)?CH4(g)△H2=-73kJ•mol-1
Ⅲ.2CO(g)?C(s)+CO2(g)△H3=-171kJ•mol-1
根据盖斯定律,Ⅲ-Ⅰ+Ⅱ可得:CO (g)+3H2(g) 
(2)氧气将-2价S氧化为S单质,根据氧化还原反应的书写方法书写反应;
(3)温度一定时,增大压强平衡逆向移动,甲烷的转化率减小;
Y点甲烷转化率小于同温同压下平衡时转化率,故Y点向正反应进行建立平衡;
温度为1100℃,压强为P2时甲烷的转化率为80%,则平衡时甲烷浓度变化量为0.1mol•L-1×70%=0.1mol,计算平衡时各组分浓度,代入K=$\frac{{c}^{2}(CO)×{c}^{2}({H}_{2})}{c(C{O}_{2})×c(C{H}_{4})}$计算平衡常数;
(4))①由图可知,该催化剂在250℃左右时催化剂效率最高;
②提高该反应中CH4的转化率,改变条件应使平衡向正反应方向移动,注意不能只增大甲烷的浓度,否则甲烷的转化率降低.
解答 解:(1)已知:Ⅰ.CO(g)+H2O(g)?H2(g)+CO2(g)△H1=-41kJ•mol-1
Ⅱ.C(s)+2H2(g)?CH4(g)△H2=-73kJ•mol-1
Ⅲ.2CO(g)?C(s)+CO2(g)△H3=-171kJ•mol-1
根据盖斯定律,Ⅲ-Ⅰ+Ⅱ可得:CO (g)+3H2(g) 
故答案为:CO (g)+3H2(g) 
(2)氧气将-2价S氧化为S单质,反应方程式为:2NH4HS+O2=2NH3•H2O+2S↓,故答案为:2NH4HS+O2=2NH3•H2O+2S↓;
(3)温度一定时,增大压强平衡逆向移动,甲烷的转化率减小,故压强P1<P2;Y点甲烷转化率小于同温同压下平衡时转化率,故Y点向正反应进行建立平衡,则v(正)>v(逆;温度为1100℃,压强为P2时甲烷的转化率为80%,则平衡时甲烷浓度变化量为0.1mol•L-1×70%=0.07mol,则:
CO2(g)+CH4(g)═2CO(g)+2H2(g)
起始浓度(mol/L):0.1 0.1 0 0
变化浓度(mol/L):0.07 0.07 0.14 0.14
平衡浓度(mol/L):0.03 0.03 0.14 0.14
故平衡常数K=K=$\frac{{c}^{2}(CO)×{c}^{2}({H}_{2})}{c(C{O}_{2})×c(C{H}_{4})}$=$\frac{0.1{4}^{2}×0.1{4}^{2}}{0.03×0.03}$(mol.L)2=1.6 mol2•L-2,
故答案为:小于;大于;1.6 mol2•L-2;
(4))①由图可知,该催化剂在250℃左右时催化剂效率最高,温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,
故答案:温度超过250℃时,催化剂的催化效率降低;
②提高该反应中CH4的转化率,改变条件应使平衡向正反应方向移动,正反应是气体体积减小的反应,缩小容器体积增大压强、增大CO2的浓度,平衡正向移动,反应物转化率增大,
故答案为:增大反应压强或增大CO2的浓度.
点评 本题考查化学平衡计算、平衡常数、化学平衡图象、盖斯定律的应用等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度中等.

| A. | 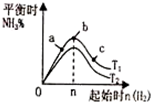 表示合成氨(放热反应),温度T1和T2对应的平衡常数为K1,K2、則:T1<T2,K1>K2 | |
| B. | 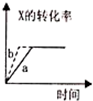 反应:X(g)+2Y(g)?3Z(g),b的溫度比a可能高 | |
| C. |  该温度下,加人FeCl3不可能引起出由b向a的变化 | |
| D. | 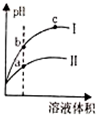 用水稀释pH相同的盐酸和醋酸,Ⅰ表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a |
| A. | 56gFe与1 molCl2充分反应转移电子数为3NA | |
| B. | 常温常压下,22 g D3O+含有10 NA个电子 | |
| C. | 25℃时,1 L pH=12的Ba(OH)2溶液中含有的OH-的数目为0.02 NA | |
| D. | 1 L0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数为0.1NA |
| 选项 | 实验内容 | 实验目的 |
| A | 测同温同浓度下的Na2CO3和Na2SO3水溶液的pH | 确定碳和硫两元素非金属性强弱 |
| B | 向CH2=CHCH2OH中滴加酸性KMnO4溶液 | 证明CH2=CHCH2OH中含有碳碳双键 |
| C | 取久置的Na2SO3溶于水,加硝酸酸化的BaCl2溶液 | 证明Na2SO3部分被氧化 |
| D | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入足量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 | 检验蔗糖水解产物具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
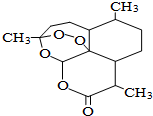 青蒿素是一种高效、速效抗疟药,是中医药献给世界的一份礼物.屠呦呦因在发现、研究青蒿素方面做出的杰出贡献而获得2015年诺贝尔医学奖.青蒿素分子结构如图,下列说法中正确的是( )
青蒿素是一种高效、速效抗疟药,是中医药献给世界的一份礼物.屠呦呦因在发现、研究青蒿素方面做出的杰出贡献而获得2015年诺贝尔医学奖.青蒿素分子结构如图,下列说法中正确的是( )| A. | 青蒿素能与热的NaOH溶液反应 | B. | 青蒿素的分子式为C15H21O5 | ||
| C. | 青蒿素分子结构中只含有极性键 | D. | 青蒿素能使酸性KMnO4溶液褪色 |
| A. | x+y>z | B. | 平衡向正反应方向移动 | ||
| C. | B 的转化率升高 | D. | C 的体积分数增加 |
| A. | V(D)=0.40 mol•L-1•s-1 | B. | V (C)=0.50 mol•L-1•s-1 | ||
| C. | V(B)=1.2 mol•L-1•min-1 | D. | V(A)=0.30 mol•L-1•s-1 |
 的一氯代物有(不考虑立体异构)( )
的一氯代物有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
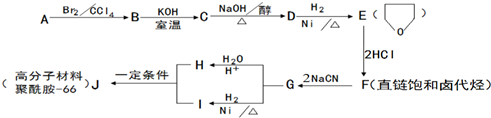
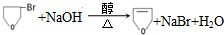 .
.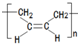 .
. .
.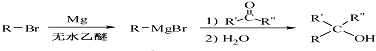
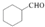 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: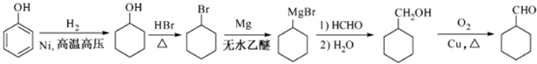 .
.