题目内容
4.设NA为阿伏加德罗常数,下列说法正确的是( )| A. | 1molFeCl3水解生成的Fe(OH)3胶粒数为1NA | |
| B. | 4.6g有机物C2H6O的分子结构中含有的C-H键数目一定为0.5NA | |
| C. | 标准状况下,11.2LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 1mol•L-1AlCl3溶液中含有3NA个Cl- |
分析 A、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
B、求出C2H6O的物质的量,然后根据C2H6O可能为乙醇也可能为二甲醚来分析;
C、求出二氧化碳的物质的量,然后根据当1mol二氧化碳参与反应时,反应转移1mol电子;
D、溶液体积不明确.
解答 解:A、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故形成的氢氧化铁胶粒的个数小于NA个,故A错误;
B、4.6gC2H6O的物质的量为0.1mol,而C2H6O可能为乙醇,也可能为二甲醚,当为乙醇时,0.1molC2H6O中含0.5NA条C-H键,当为二甲醚时,含0.6NA条C-H键,故B错误;
C、标况下11.2L二氧化碳的物质的量为0.5mol,而当1mol二氧化碳参与反应时,反应转移1mol电子,故当0.5mol二氧化碳参与反应时,转移0.5NA个电子,故C正确;
D、溶液体积不明确,故溶液中的氯离子个数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
14.化学与生产、生活密切相关.下列说法不正确的是( )
| A. | pH<7的降水成为酸雨 | |
| B. | 硅酸钠可用于制备木材防火剂 | |
| C. | 水泥、陶瓷、玻璃都属于硅酸盐产品 | |
| D. | 冬季大量使用燃煤取暖会导致雾霾的形成 |
15.在一密闭容器中一定量A、B的混合气体发生反应:aA(g)+bB(g)?cC(s)+dD(g),平衡时测得A的浓度为0.60mol/L,保持温度不变,将容器的容积扩大到原来的3倍,再达平衡时,测得A的浓度降为0.20mol/L.下列有关判断一定正确的是( )
| A. | 平衡向正反应方向移动 | B. | A的转化率增大 | ||
| C. | D的体积分数增大 | D. | a+b<c+d |
12.下列图示与对应的叙述一定正确的是( )
| A. | 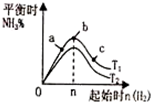 表示合成氨(放热反应),温度T1和T2对应的平衡常数为K1,K2、則:T1<T2,K1>K2 | |
| B. | 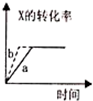 反应:X(g)+2Y(g)?3Z(g),b的溫度比a可能高 | |
| C. | 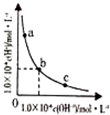 该温度下,加人FeCl3不可能引起出由b向a的变化 | |
| D. | 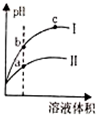 用水稀释pH相同的盐酸和醋酸,Ⅰ表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a |
19.下列物质的电子式书写正确的是( )
| A. | H2O2 | B. | Na2O | C. | OH- | D. | HF |
13.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 56gFe与1 molCl2充分反应转移电子数为3NA | |
| B. | 常温常压下,22 g D3O+含有10 NA个电子 | |
| C. | 25℃时,1 L pH=12的Ba(OH)2溶液中含有的OH-的数目为0.02 NA | |
| D. | 1 L0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数为0.1NA |
14.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g).平衡时测得 A 的浓度为0.50mol/L.保持温度不变,将容器的容积扩大到原来的两倍再达到平衡时,测得A的浓度为 0.30mol/L.下列判断正确的是( )
| A. | x+y>z | B. | 平衡向正反应方向移动 | ||
| C. | B 的转化率升高 | D. | C 的体积分数增加 |

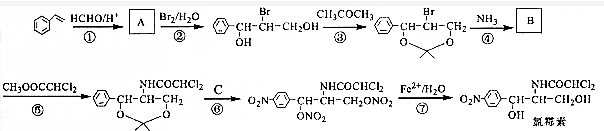
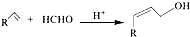
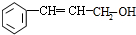 ;C的名称硝酸.
;C的名称硝酸.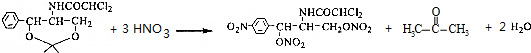 .
.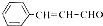 的合成路线.
的合成路线.