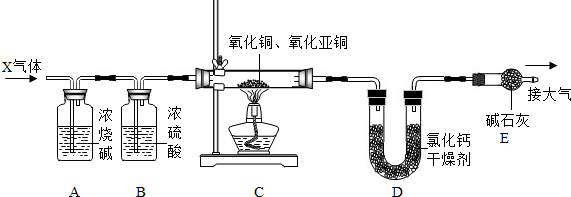
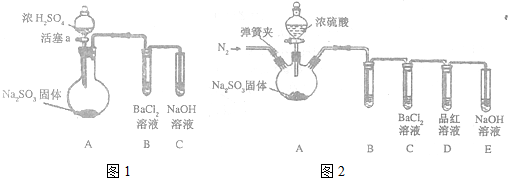
题目内容
4.升高温度,下列常数中不一定增大的是( )| A. | 电离常数Ka | B. | 化学平衡常数K | ||
| C. | 水的离子积常数Kw | D. | 盐的水解常数Kh |
分析 升高温度,反应速率加快,平衡常数与温度有关,结合平衡移动分析K的变化,以此来解答.
解答 解:A.弱酸弱碱的电离吸热,则升高温度电离平衡常数Ka增大,故A不选;
B.可能为吸热反应,也可能为放热反应,则升高温度,可能正向移动或逆向移动,化学平衡常数K不一定增大,故B选;
C.水的电离吸热,则升高温度水的离子积常数Kw增大,故C不选;
D.水解反应吸热,则升高温度盐类的水解平衡常数Kh增大,故D不选;
故选B.
点评 本题考查化学反应速率的影响因素及平衡移动的影响因素,为高频考点,把握反应的特点及受温度的影响为解答的关键,注意平衡常数只受温度的影响,题目难度中等.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案
相关题目
14.现代以石油化工为基础的三大合成材料是( )
| A. | 合成洗涤剂 | B. | 合成纤维 | C. | 合成橡胶 | D. | 塑料 |
15.氢化钠与水反应:NaH+H2O=NaOH+H2↑,对该反应的描述正确的是( )
| A. | NaH是氧化剂 | B. | H2O是氧化剂 | ||
| C. | 氧化剂与还原剂的质量比为1:1 | D. | 每生成1molH2转移2mol电子 |
12.下列有关原电池说法中正确的是( )
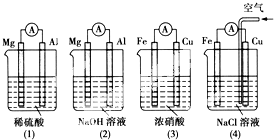

| A. | (1)(2)中活泼的Mg均作负极 | |
| B. | (2)中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑ | |
| C. | (3)中Fe作负极,电极反应式为Fe-2e-=Fe2+ | |
| D. | (4)中Cu作正极,电极反应式为2H++2e-=H2↑ |
9.用NA表示阿伏伽德罗常数的值,下列说法不正确的是( )
| A. | 28gCO与N2的混合物中含有的分子总数为NA | |
| B. | 常温、常压下,22.4LO2中含有的O2分子数为NA | |
| C. | 1L1mol•L-1K2SO4溶液中含有的钾离子数为2NA | |
| D. | 过量的铁1molCl2充分反应时,铁失去的电子数为2NA |
14.下列实验操作中错误的是( )
| A. | 蒸发操作时,应使混合物中的水完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中的下层液体从下口流出,上层液体从上口倒出 | |
| D. | 萃取操作时,溶质在萃取剂中的溶解度应大于在原溶剂中的溶解度 |