题目内容
14 6 |
14 6 |
| A、中子数为14 | ||
| B、质子数为14 | ||
| C、核外电子数为14 | ||
D、
|
考点:核素
专题:原子组成与结构专题
分析:原子符号ZAX,左下角Z代表质子数,左上角A代表质量数,X代表元素符号,其中质量数=质子数+中子数.中性原子有质子数=原子序数=核电荷数=核外电子数,利用同位素的概念解答D.
解答:
解:A、614C的质子数位6,质量数位14,中子数为14-6=8,故A错误;
B、614C原子的质子数为6,故B错误;
C、614C原子的质子数为6,核外电子数为6,故C错误;
D、质子数相同,质量数不同的同一种元素的不同种原子互称同位素,故D正确;
故选:D.
B、614C原子的质子数为6,故B错误;
C、614C原子的质子数为6,核外电子数为6,故C错误;
D、质子数相同,质量数不同的同一种元素的不同种原子互称同位素,故D正确;
故选:D.
点评:本题考查学生对原子符号的理解、原子构成中微粒之间的关系等,比较基础,注意基础知识的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、将蔗糖溶于水不能导电且其熔融状态也不能导电,故蔗糖不是电解质 |
| B、CO2溶于水得到的溶液能导电,所以CO2是电解质 |
| C、金属能导电,所以金属是电解质 |
| D、固态的NaCl不导电,所以 NaCl不是电解质 |
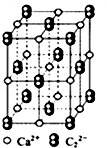 CaC2晶体的晶胞结构与NaCl的相似(如图),但CaC2晶体中含有哑铃形C22-的存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )
CaC2晶体的晶胞结构与NaCl的相似(如图),但CaC2晶体中含有哑铃形C22-的存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )| A、6.4克CaC2晶体中含阴离子0.2 mol |
| B、该晶体中的阴离子与N2是互为等电子体 |
| C、1个Ca2+周围距离最近且等距离的C22-数目为6 |
| D、与每个Ca2+距离相等且最近的Ca2+共有12个 |
下列反应的离子方程式中,书写正确的是( )
| A、铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ |
| B、Fe跟稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| C、金属钾投入到硫酸铜溶液中:2K+Cu2+=2K++Cu |
| D、铜跟稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O |
短周期元素X、T、Y、Z、R原子序数依次增大,T最内层电子数是最外层的2倍,元素的化合价关系如下表,则下列判断正确的是( )
| X | Y | Z | R | |
| 主要化合物 | -4,+4 | -4,+4 | -2,+6 | -1,+7 |
| A、非金属性:Z<R<Y |
| B、T与R可以形成化合物TR2 |
| C、X与R的单质均能使品红溶液褪色 |
| D、T的最高价氧化物的水化物能与X、Y、Z的最高价氧化物反应 |
利用下列实验装置进行的相应实验,不能达到实验目的是( )
A、 可制取氨气 |
B、 可分离CH3CH2OH和CH3COOC2H5混合液 |
C、 可制备Fe(OH)2并容易观察到白色沉淀 |
D、 可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂自性、还原性 |
 过二硫酸的化学式为H2S2O8,硫元素的形式氧化态可看作是+7,所以是一种强氧化剂.工业上常用电解硫酸和硫酸钾的混合溶液制过二硫酸钾,且在65℃时熔化并分解.电解反应的离子方程式是:2HSO
过二硫酸的化学式为H2S2O8,硫元素的形式氧化态可看作是+7,所以是一种强氧化剂.工业上常用电解硫酸和硫酸钾的混合溶液制过二硫酸钾,且在65℃时熔化并分解.电解反应的离子方程式是:2HSO