题目内容
下列反应的离子方程式中,书写正确的是( )
| A、铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ |
| B、Fe跟稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| C、金属钾投入到硫酸铜溶液中:2K+Cu2+=2K++Cu |
| D、铜跟稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O |
考点:离子方程式的书写
专题:
分析:A.漏写氧化剂水;
B.反应生成氯化亚铁和氢气;
C.反应生成氢氧化铜、氢气、硫酸钾;
D.反应生成硝酸铜、NO和水,遵循电子、电荷守恒.
B.反应生成氯化亚铁和氢气;
C.反应生成氢氧化铜、氢气、硫酸钾;
D.反应生成硝酸铜、NO和水,遵循电子、电荷守恒.
解答:
解:A.铝粉投入到NaOH溶液中的离子反应为2H2O+2Al+2OH-=2AlO2-+3H2↑,故A错误;
B.Fe跟稀盐酸反应的离子反应为Fe+2H+=Fe2++H2↑,故B错误;
C.金属钾投入到硫酸铜溶液中的离子反应为2K+2H2O+Cu2+=2K++Cu(OH)2↓+H2↑,故C错误;
D.铜跟稀硝酸反应的离子反应为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,故D正确;
故选D.
B.Fe跟稀盐酸反应的离子反应为Fe+2H+=Fe2++H2↑,故B错误;
C.金属钾投入到硫酸铜溶液中的离子反应为2K+2H2O+Cu2+=2K++Cu(OH)2↓+H2↑,故C错误;
D.铜跟稀硝酸反应的离子反应为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,故D正确;
故选D.
点评:本题考查离子反应书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
甲、乙两种溶液中分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-这6种离子中的3种(两种溶液中的离子不重复),已知甲溶液呈蓝色,则乙溶液中大量存在的离子是( )
| A、K+、OH-、CO32- |
| B、Cu2+、H+、Cl- |
| C、K+、H+、Cl- |
| D、CO32-、OH-、Cl- |
下列叙述正确的是( )
| A、在氧化还原反应中,非金属单质一定是氧化剂 |
| B、置换反应一定是氧化还原反应 |
| C、阳离子只能得到电子,阴离子只能失去电子 |
| D、金属阳离子被还原一定得到金属单质 |
关于周期表的知识,下列说法正确的是( )
| A、周期表共有七个主族,七个副族,一个零族,一个第八族,所以共有16个纵列 |
| B、元素周期表中,元素种类最多的周期是第四周期 |
| C、第七周期叫做不完全周期 |
| D、碱金属元素就是ⅠA元素 |
已知某300ml MgCl2 与AlCl3的混合液,若往其中滴加NaOH溶液,要使沉淀达到最大值,需消耗0.5mol/L的NaOH溶液600ml;则混合液中c(Cl-)是( )
| A、0.6 mol/L |
| B、0.8 mol/L |
| C、1.0 mol/L |
| D、1.2 mol/L |
下列反应的离子方程式书写正确的是( )
| A、氢氧化镁与稀盐酸反应:H++OH-═H2O |
| B、氯化钡溶液与硫酸钠溶液反应:Ba2++SO42-═BaSO4↓ |
| C、碳酸钠溶液与足量醋酸反应:Na2CO3+2H+═2Na++CO2↑+H2O |
| D、FeCl3溶液中加入Fe粉:Fe3++Fe═2Fe2+ |
14 6 |
14 6 |
| A、中子数为14 | ||
| B、质子数为14 | ||
| C、核外电子数为14 | ||
D、
|
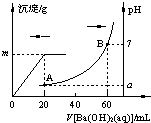 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )| A、图中A点对应溶液的pH:a=1 |
| B、生成沉淀的最大质量m=2.33g |
| C、原混合液中c(HCl)=0.2mol?L-1 |
| D、当V[Ba(OH)2(aq)]=30mL时,有关离子浓度大小:c(Cl-)>c(Ba2+)>c(H+) |