题目内容
短周期元素X、T、Y、Z、R原子序数依次增大,T最内层电子数是最外层的2倍,元素的化合价关系如下表,则下列判断正确的是( )
| X | Y | Z | R | |
| 主要化合物 | -4,+4 | -4,+4 | -2,+6 | -1,+7 |
| A、非金属性:Z<R<Y |
| B、T与R可以形成化合物TR2 |
| C、X与R的单质均能使品红溶液褪色 |
| D、T的最高价氧化物的水化物能与X、Y、Z的最高价氧化物反应 |
考点:原子结构与元素的性质,原子结构与元素周期律的关系
专题:
分析:短周期元素X、T、Y、Z、R原子序数依次增大,T最内层电子数是最外层的2倍,最外层电子数为1,处于IA族,X、Y均有+4、-4价,处于ⅣA族,结合原子序数可知,X为C、Y为Si、T为Na,Z有-2、+6价,则Z为S元素,R有+7、-1价,则R为Cl,结合元素周期律与元素化合物性质解答.
解答:
解:短周期元素X、T、Y、Z、R原子序数依次增大,T最内层电子数是最外层的2倍,最外层电子数为1,处于IA族,X、Y均有+4、-4价,处于ⅣA族,结合原子序数可知,X为C、Y为Si、T为Na,Z有-2、+6价,则Z为S元素,R有+7、-1价,则R为Cl,
A.Z、R、Y分别是S、Cl、Si元素,同一周期元素,元素非金属性随着原子序数增大而增强,所以非金属性Y<Z<R,故A错误;
B.T是Na元素、R是Cl元素,二者可以形成化合物NaCl,故B错误;
C.X的单质是碳、R的单质是氯气,活性炭有吸附性,次氯酸有漂白性,氯气没有漂白性,故C错误;
D.T的最高价氧化物的水化物是NaOH,X、Y、Z的最高价氧化物分别是CO2、SiO2、SO3,这三种氧化物都是酸性氧化物,都含有和NaOH溶液反应生成盐和水,故D正确;
故选D.
A.Z、R、Y分别是S、Cl、Si元素,同一周期元素,元素非金属性随着原子序数增大而增强,所以非金属性Y<Z<R,故A错误;
B.T是Na元素、R是Cl元素,二者可以形成化合物NaCl,故B错误;
C.X的单质是碳、R的单质是氯气,活性炭有吸附性,次氯酸有漂白性,氯气没有漂白性,故C错误;
D.T的最高价氧化物的水化物是NaOH,X、Y、Z的最高价氧化物分别是CO2、SiO2、SO3,这三种氧化物都是酸性氧化物,都含有和NaOH溶液反应生成盐和水,故D正确;
故选D.
点评:本题考查原子结构和元素性质,侧重考查学生分析、推断能力,明确物质性质、元素周期表结构、元素周期律知识即可解答,注意活性炭、次氯酸、二氧化硫漂白原理区别,题目难度不大.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、在氧化还原反应中,非金属单质一定是氧化剂 |
| B、置换反应一定是氧化还原反应 |
| C、阳离子只能得到电子,阴离子只能失去电子 |
| D、金属阳离子被还原一定得到金属单质 |
14 6 |
14 6 |
| A、中子数为14 | ||
| B、质子数为14 | ||
| C、核外电子数为14 | ||
D、
|
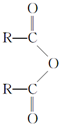
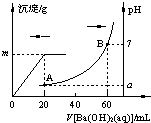 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )| A、图中A点对应溶液的pH:a=1 |
| B、生成沉淀的最大质量m=2.33g |
| C、原混合液中c(HCl)=0.2mol?L-1 |
| D、当V[Ba(OH)2(aq)]=30mL时,有关离子浓度大小:c(Cl-)>c(Ba2+)>c(H+) |
某小组利用下列装置进行电化学实验,盐桥中填充琼脂及饱和KNO3溶液,下列说法正确的是( )
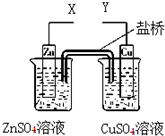

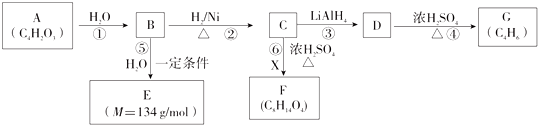
A、若X和Y与电流表 连接,则电流方向:锌电极→ 连接,则电流方向:锌电极→ →铜电极 →铜电极 |
B、若X和Y与电流表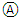 连接,盐桥中的K+向左边烧杯移动 连接,盐桥中的K+向左边烧杯移动 |
| C、若X和Y分别与电源“-”、“+”极相连,Cu极发生氧化反应 |
| D、若X和Y分别与电源“-”、“+”极相连,Zn极质量减轻 |
 A
A