题目内容
 过二硫酸的化学式为H2S2O8,硫元素的形式氧化态可看作是+7,所以是一种强氧化剂.工业上常用电解硫酸和硫酸钾的混合溶液制过二硫酸钾,且在65℃时熔化并分解.电解反应的离子方程式是:2HSO
过二硫酸的化学式为H2S2O8,硫元素的形式氧化态可看作是+7,所以是一种强氧化剂.工业上常用电解硫酸和硫酸钾的混合溶液制过二硫酸钾,且在65℃时熔化并分解.电解反应的离子方程式是:2HSO- 4 |
| ||
2- 8 |
(1)阴极池是
(2)硫酸和硫酸钾的混合溶液从A口逐渐流入,含K2S2O8和H2S2O8的粗产品从
(3)阳极的副产物是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)根据与电源负极相连的为阴极发生还原反应,与正极相连的为阳极发生氧化反应来判断;
(2)根据阴极、阳极的反应产物判断;
(3)阳极OH-放电生成氧气,据此分析.
(2)根据阴极、阳极的反应产物判断;
(3)阳极OH-放电生成氧气,据此分析.
解答:
解:(1)与电源负极相连的为阴极,则阴极池是右,根据2HSO
S2O
+H2↑,所以阴极氢离子得电子发生还原反应,反应式为2H++2e-=H2↑,阳极硫酸氢根失电子生成过二硫酸根发生氧化反应,反应式为2HSO4--2e-=S2O82-+2H+;故答案为:右;2H++2e-=H2↑;2HSO4--2e-=S2O82-+2H+;
(2)由阳极反应式为2HSO4--2e-=S2O82-+2H+,则含K2S2O8和H2S2O8的粗产品阳极产生,所以应从C口流出;阴极氢离子得电子发生还原反应,反应式为2H++2e-=H2↑,所以应从B口逐渐补充的物质是H2O,故答案为:C;H2O;
(3)阳极OH-放电生成氧气,反应式为4OH--4e-=O2↑+2H2O;故答案为:O2;4OH--4e-=O2↑+2H2O.
- 4 |
| ||
2- 8 |
(2)由阳极反应式为2HSO4--2e-=S2O82-+2H+,则含K2S2O8和H2S2O8的粗产品阳极产生,所以应从C口流出;阴极氢离子得电子发生还原反应,反应式为2H++2e-=H2↑,所以应从B口逐渐补充的物质是H2O,故答案为:C;H2O;
(3)阳极OH-放电生成氧气,反应式为4OH--4e-=O2↑+2H2O;故答案为:O2;4OH--4e-=O2↑+2H2O.
点评:本题考查了电解池原理,能根据信息正确判断两极的反应是解本题的关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列变化中,属于被氧化的是( )
| A、CaO→Ca(OH)2 |
| B、Cu2+→Cu |
| C、Fe2+→Fe3+ |
| D、CO2→CO |
已知某300ml MgCl2 与AlCl3的混合液,若往其中滴加NaOH溶液,要使沉淀达到最大值,需消耗0.5mol/L的NaOH溶液600ml;则混合液中c(Cl-)是( )
| A、0.6 mol/L |
| B、0.8 mol/L |
| C、1.0 mol/L |
| D、1.2 mol/L |
14 6 |
14 6 |
| A、中子数为14 | ||
| B、质子数为14 | ||
| C、核外电子数为14 | ||
D、
|
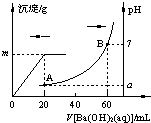 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )| A、图中A点对应溶液的pH:a=1 |
| B、生成沉淀的最大质量m=2.33g |
| C、原混合液中c(HCl)=0.2mol?L-1 |
| D、当V[Ba(OH)2(aq)]=30mL时,有关离子浓度大小:c(Cl-)>c(Ba2+)>c(H+) |
 工、农业废水以及生活污水中浓度较高的NO3-会造成氮污染.工业上处理水体中NO3-的一种方法是零价铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下.
工、农业废水以及生活污水中浓度较高的NO3-会造成氮污染.工业上处理水体中NO3-的一种方法是零价铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下.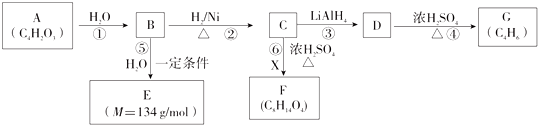
 A
A