题目内容
5.将标准状况下8.96LHCl气体溶于水配成100mL溶液,所得溶液溶质的物质的量浓度为4mol/L,假如所得溶液的密度为1g/mL,则溶质的质量百分数为14.6%.分析 根据n=$\frac{V}{{V}_{m}}$计算出标准状况下8.96LHCl的物质的量,然后根据c=$\frac{n}{V}$计算出所得溶液的物质的量浓度;计算出1L该溶液的质量,然后根据m=nM计算出溶质的质量,最后根据w=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%计算出所得溶液中溶质的质量分数.
解答 解:标准状况下8.96L HCl的物质的量为:$\frac{8.96L}{22.4L/mol}$=0.4mol,所得溶液的物质的量浓度为:c(HCl)=$\frac{0.4mol}{0.1L}$4mol/L;
1L该溶液中含有HCl的物质的量为:4mol/L×1L=4mol,含有溶质的质量为:36.5g/mol×4mol=146g,该溶液的质量为:1g/mL×1000mL=1000g,所以该溶液中溶质的质量分数为:$\frac{146g}{1000g}$×100%=14.6%,
故答案为:4mol/L;14.6%.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意掌握溶质质量分数的表达式及计算方法,试题培养了学生的化学计算能力.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
15.下列关于有机物的说法正确的是( )
| A. | 1,3-丁二烯与溴单质加成的产物只有2种 | |
| B. | 酚酞( )属于醇 )属于醇 | |
| C. | 可以用溴水将四氯化碳和乙醇鉴别开来 | |
| D. | 分子组成相差一个或若干个CH2原子团的化合物肯定互为同系物 |
16.室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是( )
| A. | 0.1mol/L的盐酸和0.1mol/L的氨水溶液 | |
| B. | 0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液 | |
| C. | pH=4的醋酸溶液和pH=10的氢氧化钠溶液 | |
| D. | pH=4的盐酸和pH=l0的氨水 |
13.下列反应的化学方程式正确的是( )
| A. | 乙烯和溴单质反应:CH2═CH2+Br2→CH2-CH2Br2 | |
| B. | 合成聚乙烯塑料:nCH2═CH2→ | |
| C. | 皂化反应: +3H2O$→_{△}^{H+}$ +3H2O$→_{△}^{H+}$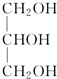 +3C17H35COOH +3C17H35COOH | |
| D. | 乙醇与金属钠反应:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ |
3. X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若W原子的最外层电子数是内层电子总数的$\frac{7}{10}$,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若W原子的最外层电子数是内层电子总数的$\frac{7}{10}$,下列说法中正确的是( )
 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若W原子的最外层电子数是内层电子总数的$\frac{7}{10}$,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若W原子的最外层电子数是内层电子总数的$\frac{7}{10}$,下列说法中正确的是( )| A. | 阴离子的半径从大到小排列顺序为:X>Y>Z>W | |
| B. | X、Y、Z、W元素的氢化物分子间都可以形成氢键 | |
| C. | Y的两种同素异形体在常温下可以相互转化 | |
| D. | 最高价氧化物对应的水化物的酸性:W>Z |
10.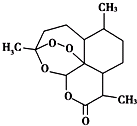 2015年,中国科学家屠呦呦获得了诺贝尔医学奖,因为发现青蒿素,一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.
2015年,中国科学家屠呦呦获得了诺贝尔医学奖,因为发现青蒿素,一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.
如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
 2015年,中国科学家屠呦呦获得了诺贝尔医学奖,因为发现青蒿素,一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.
2015年,中国科学家屠呦呦获得了诺贝尔医学奖,因为发现青蒿素,一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
| A. | 青蒿素分子式为C15H22O5 | |
| B. | 青蒿素易溶于乙醇、苯 | |
| C. | 青蒿素因含有-O-(醚键)而具有较强的氧化性 | |
| D. | 青蒿素在碱性条件下易发生水解反应 |
7. 如表是部分短周期元素的原子半径及常见化合价如表:
如表是部分短周期元素的原子半径及常见化合价如表:
(1)E元素在元素周期表的位置是第三周期VIA族,C为氯(填元素名称).
(2)B的最高价氧化物与硝酸反应的离子方程式为Al2O3+6H+=2Al3++3H2O
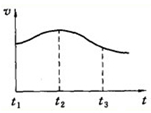
(3)某学生做A与盐酸反应的实验,去除表面的氧化镁等杂质,反应过程中感觉试管外壁发烫,试说明原因镁与盐酸的反应是放热反应,1gA完全反应放出热量为QKJ,则该反应的热化学方程式为Mg(s)+2HCl(aq)=MgCl2(aq)+H2(g)△H1=-24QKJ•mol-1该学生通过实验测得A与盐酸反应产生气体的速率(v):与时间(t)的关系如图所示,则t1~t2时间内反应速率逐渐加快的主要原因:镁与盐酸反应放热,温度升高反应速率加快.
 如表是部分短周期元素的原子半径及常见化合价如表:
如表是部分短周期元素的原子半径及常见化合价如表:| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.099 | 0.074 | 0.102 |
| 常见化合价 | +2 | +3 | -1 | -2 | +6,-2 |
(2)B的最高价氧化物与硝酸反应的离子方程式为Al2O3+6H+=2Al3++3H2O
(3)某学生做A与盐酸反应的实验,去除表面的氧化镁等杂质,反应过程中感觉试管外壁发烫,试说明原因镁与盐酸的反应是放热反应,1gA完全反应放出热量为QKJ,则该反应的热化学方程式为Mg(s)+2HCl(aq)=MgCl2(aq)+H2(g)△H1=-24QKJ•mol-1该学生通过实验测得A与盐酸反应产生气体的速率(v):与时间(t)的关系如图所示,则t1~t2时间内反应速率逐渐加快的主要原因:镁与盐酸反应放热,温度升高反应速率加快.
8.化学能与热能、电能等可以相互转化,关于化学能与其它能量相互转化的说法正确的是( )

| A. | 图I所示的装置能将化学能转变为电能 | |
| B. | 图II所示的反应为吸热反应 | |
| C. | 中和反应中,反应物的总能量比生成物的总能量低 | |
| D. | 化学反应中能量变化的主要原因是化学键的断裂与生成 |