题目内容
已知在室温时纯水中存在电离平衡:H2O?H++OH-.下列叙述正确的是( )
| A、向水中加入少量NH4Cl,由水电离出的c(H+)>1×10-7mol/L |
| B、升高温度,水的电离程度增大,c(H+)增大,pH<7,所以溶液显酸性 |
| C、向水中加入氨水,平衡逆向移动,水的电离受到抑制,所以c(OH-)降低 |
| D、向水中加入少量硫酸,c(H+)增大,所以由水电离出的c(H+)>1×10-7mol/L |
考点:水的电离
专题:电离平衡与溶液的pH专题
分析:A.盐类水解能够促进水的电离;
B.水电离是吸热过程,升温促进水的电离;溶液酸碱性取决于氢离子和氢氧根离子浓度的相对大小;
C.向水中加入氨水,氢氧根离子的浓度增大,抑制水的电离,碱性增强;
D.向水中加硫酸能抑制水电离,从而确定水电离出氢离子浓度的变化.
B.水电离是吸热过程,升温促进水的电离;溶液酸碱性取决于氢离子和氢氧根离子浓度的相对大小;
C.向水中加入氨水,氢氧根离子的浓度增大,抑制水的电离,碱性增强;
D.向水中加硫酸能抑制水电离,从而确定水电离出氢离子浓度的变化.
解答:
解:影响水的电离平衡的因素主要有:温度升高促进电离;加酸、碱抑制水的电离;加入能水解的盐促进水的电离;一定温度下水的离子积不变.
A.氯化铵是可水解的盐,对水的电离起促进作用,所以由水电离出的c(H+)>1×10-7 mol/L,故A正确;
B.水的电离是吸热过程,升高温度促进水电离,由水电离产生的氢离子浓度增大,所以pH<7;水电离产生的氢离子浓度等于氢氧根离子浓度,所以溶液呈中性,故B错误;
C.一水合氨是弱碱,虽然抑制水的电离,但氨水电离产生的氢氧根离子浓度远远大于水电离出的氢氧根离子浓度,所以c(OH-)增大,故C错误;
D.硫酸是强酸,完全电离,c(H+)增大,所以抑制水了电离,由水电离出的c(H+)<1×10-7mol/L,故D错误;
故选A.
A.氯化铵是可水解的盐,对水的电离起促进作用,所以由水电离出的c(H+)>1×10-7 mol/L,故A正确;
B.水的电离是吸热过程,升高温度促进水电离,由水电离产生的氢离子浓度增大,所以pH<7;水电离产生的氢离子浓度等于氢氧根离子浓度,所以溶液呈中性,故B错误;
C.一水合氨是弱碱,虽然抑制水的电离,但氨水电离产生的氢氧根离子浓度远远大于水电离出的氢氧根离子浓度,所以c(OH-)增大,故C错误;
D.硫酸是强酸,完全电离,c(H+)增大,所以抑制水了电离,由水电离出的c(H+)<1×10-7mol/L,故D错误;
故选A.
点评:本题考查了水的电离平衡影响因素,解题时注意分清氢离子或氢氧根离子的来源.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
柑橘中柠檬烯的结构可表示为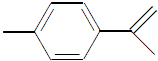 ,下列关于这种物质的说法中正确的是( )
,下列关于这种物质的说法中正确的是( )
 ,下列关于这种物质的说法中正确的是( )
,下列关于这种物质的说法中正确的是( )| A、分子式为C9H12 |
| B、易发生取代反应,难发生加成反应 |
| C、可使溴的四氯化碳溶液褪色 |
| D、该物质易溶于水 |
将pH=6的CH3COOH溶液加水稀释1000倍后,溶液中的( )
| A、pH=9 |
| B、c(OH-)≈10-5 mol?L-1 |
| C、pH≈7 |
| D、c(OH-)<10-7 mol?L-1 |
25℃时,某溶液中含有Na+、H+、Fe3+、HC03-、OH-、I-中的几种离子,已知由水电离出的c(H+)=1×10-13 mol?L-1.向该溶液中缓慢通人一定量的Cl2后,溶液由无色变为黄色.下列关于该溶液的分析,错误的是( )
| A、pH=l或pH=13 |
| B、阴离子肯定有I-,不能确定有无HCO3 |
| C、阴离子肯定没有Fe3+,不能确定有无Na+ |
| D、溶质有3种可能:①HI②HI和NaI③NaI和NaOH |
下列变化属于吸收能(热)量的是( )
| A、Cu+稀HNO3→ |
| B、H2O→H++OH- |
| C、CO→C+CO2 |
| D、H2+O2→H2O |
下列各组微粒中,互为同位素的是( )
| A、金刚石和石墨 | ||||
B、
| ||||
| C、D2O和H2O | ||||
D、
|
下列有关实验原理、装置、操作或结论的描述中,正确的是( )


| A、图①装置的烧杯中先出现白色沉淀后溶解 |
| B、图②装置可验证氧化性:ClO->Cl2>Fe3+ |
| C、图③装置可用于实验室制备乙烯 |
| D、图④装置可证明Na2CO3比NaHCO3更稳定 |
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、标准状况下,22.4L CCl4含有NA个分子 |
| B、常温常压下46g NO2和N2O4混合气体含有3NA个原子 |
| C、0.1mol AlCl3完全转化为氢氧化铝胶体,生成0.lNA个胶体粒子 |
| D、0.1mol Cl2与足量NaOH溶液反应,转移电子数为0.2NA |