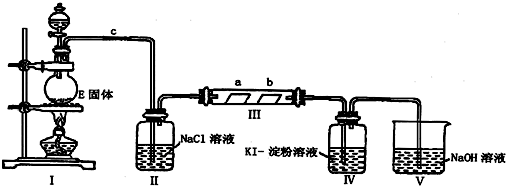
题目内容
7.现有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3、Na2SO4现做以下实验:①将部分粉末加入水中,振荡,有白色沉淀产生:
②向①的悬浊液中加入过量稀盐酸,白色沉淀部分溶解,并有气泡放出:
③取少量②的上层清液滴入硝酸银溶液,有白色沉淀生成.
根据上述实验现象,回答下列问题:
(1)判断原白色粉末中肯定含有,Ba(NO3)2、K2CO3、Na2SO4,可能含有CaCl2.
(2)写出上述实验中一定发生的有关反应的离子反应方程式:Ba2++CO32-=BaCO3↓、Ba2++SO42-=BaSO4↓、BaCO3+2H+=Ba2++H2O+CO2↑、Ag++Cl-=AgCl↓.
分析 ①将部分粉末加入水中,振荡,有白色沉淀产生,则Ba(NO3)2、CaCl2至少一种,K2CO3、Na2SO4至少一种:
②向①的悬浊液中加入过量稀盐酸,白色沉淀部分溶解,并有气泡放出,则不溶解的沉淀为硫酸钡,生成气体为二氧化碳,则一定存在Ba(NO3)2、K2CO3、Na2SO4:
③取少量②的上层清液滴入硝酸银溶液,有白色沉淀生成,应为AgCl沉淀,但加入盐酸,引入氯离子,不能确定是否含有氯化钙,以此解答该题.
解答 解:①将部分粉末加入水中,振荡,有白色沉淀产生,则Ba(NO3)2、CaCl2至少一种,K2CO3、Na2SO4至少一种:
②向①的悬浊液中加入过量稀盐酸,白色沉淀部分溶解,并有气泡放出,则不溶解的沉淀为硫酸钡,生成气体为二氧化碳,则一定存在Ba(NO3)2、K2CO3、Na2SO4:
③取少量②的上层清液滴入硝酸银溶液,有白色沉淀生成,应为AgCl沉淀,但加入盐酸,引入氯离子,不能确定是否含有氯化钙,
(1)由以上分析可知一定含有Ba(NO3)2、K2CO3、Na2SO4,不能确定是否含有CaCl2,故答案为:Ba(NO3)2、K2CO3、Na2SO4;CaCl2;
(2)一定含有Ba(NO3)2、K2CO3、Na2SO4,溶于水可发生Ba2++CO32-=BaCO3↓、Ba2++SO42-=BaSO4↓,加入盐酸反应BaCO3+2H+=Ba2++H2O+CO2↑,③加入硝酸银发生Ag++Cl-=AgCl↓,
故答案为:Ba2++CO32-=BaCO3↓、Ba2++SO42-=BaSO4↓、BaCO3+2H+=Ba2++H2O+CO2↑、Ag++Cl-=AgCl↓.
点评 本题考查物质检验和鉴别,为高频考点,把握物质的性质及实验现象为解答的关键,侧重分析推断能力及知识综合应用能力的考查,注意常见离子的检验方法,题目难度不大.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案| A. | 一个反应能否自发进行,由焓变、熵变、反应温度共同决定 | |
| B. | 在同一条件下,不同物质有不同的熵变,其体系混乱度越大,熵值越小 | |
| C. | 自发进行的反应一定能迅速发生 | |
| D. | 低温时,吸热且熵减的反应可能会自发发生 |
①将一小块钠投入滴有石蕊试液的水中,反应后溶液变蓝
②将钠投入稀盐酸中,钠先与水反应,后与盐酸反应
③钠在水蒸气中反应时因温度高会燃烧
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,两者放出的氢气质量相等.
| A. | ①② | B. | ①②③ | C. | ②③④ | D. | ①②③④ |
| A. | 证明醋酸的酸性比碳酸强:2CH3COOH+CaCO3═Ca2++H2O+2CH3COO-+CO2↑ | |
| B. | 证明FeCl2溶液已变质:Fe3++3SCN-═Fe(SCN)3 | |
| C. | 证明Al(OH)3有酸性:Al( OH)3+NH3•H2O═AlO2-+NH4++2H2O | |
| D. | 证明氧化性Fe3+>Cu2+:2Fe3++Cu═Cu2++2Fe2+ |
| A. | 用蒸馏法可实现海水的淡化 | |
| B. | 乙醇可以用作“提取碘水中的碘”的萃取剂 | |
| C. | 用“蒸发结晶”的方法从氯化钠溶液中分离得到氯化钠晶体 | |
| D. | 除去氧化铁中的氧化铝杂质:用NaOH溶液浸泡,再过滤、洗涤、干燥,即可得到纯净氧化铁 |