题目内容
20.合理的利用吸收工业产生的废气CO2、NO2、SO2等可以减少污染,变废为宝.(1)用CO2可以生产燃料甲醇.
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=-akJ•mol-1;
2H2(g)+O2(g)═2H2O(l)△H=-b kJ•mol-1;
则表示CH3OH(g)燃烧的热化学方程式为:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=2a-3bkJ•mol-1.
(2)光气(COCl2)是一种重要化工原料,常用于聚酯类材料的生产,工业上通过Cl2(g)+CO(g)?COCl2(g)△H<0制备.图1为实验研究过程中容器内各物质的浓度随时间变化的曲线.回答下列问题:
①0~6min内,反应的平均速率v(Cl2)=0.15mol•L-1•min-1 ;
②该反应第一次达平衡时的平衡常数为30,10min改变的条件是升高温度.
(3)利用氨水可以将SO2和NO2吸收,原理如图2所示:NO2被吸收的离子方程式是2NO2+4HSO3-═N2+4SO42-+4H+.
(4)以甲醇燃料电池为电源,粗硅为原料,熔融盐电解法制取硅烷原理如图3,判断A为电源的负极,电解时阳极的电极反应式为Si+4H--4e-═SiH4↑.

分析 (1)①CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=-akJ•mol-1;
②2H2(g)+O2(g)═2H2O(l)△H=-b kJ•mol-1;
利用盖斯定律计算②×3-①×2得到表示CH3OH(g)燃烧的热化学方程式;
(2)①由图可知,△c(Cl2)=1.2mol/L-0.3mol/L,结合v=$\frac{△c}{△t}$计算;
②平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,由图可知,第10 min时平衡逆向移动,据影响平衡移动的因素分析,升温平衡向逆反应方向移动,平衡常数减小;
(3)二氧化氮具有强的氧化性,能够氧化亚硫酸氢根离子生成硫酸根离子,二氧化氮被还原为氮气;
(4)电解池中的阳极上发生失电子的氧化反应,单质硅失电子后和H-结合生成SiH4.
解答 解:(1)①CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=-akJ•mol-1;
②2H2(g)+O2(g)═2H2O(l)△H=-b kJ•mol-1;
利用盖斯定律计算②×3-①×2得到表示CH3OH(g)燃烧的热化学方程式:2CH3OH(g)+3O2(g)=2CO2 (g)+4H2O(l)△H=2a-3b kJ•mol-1 ,
故答案为:2CH3OH(g)+3O2(g)=2CO2 (g)+4H2O(l)△H=2a-3b kJ•mol-1;
(2)①由图可知,6min时Cl2的平衡浓度为0.3mol/L,浓度变化为1.2mol/L-0.3mol/L=0.9mol/L,则v(Cl2)=$\frac{0.9mol/L}{6min}$=0.15 mol•L-1•min -1,
故答案为:0.15 mol•L-1•min-1 ;
②Cl2(g)+CO(g)?COCl2(g),第一次达到平衡状态,c(CO)=0.1mol/L,c(Cl2)=0.3mol/L,c(COCl2)=0.9mol/L,反应第一次达平衡时的平衡常数K=$\frac{0.9}{0.1×0.3}$=30,
影响平衡移动的因素有温度、浓度和压强,该反应是放热反应,由图可知,第10 min时平衡逆向移动,只能是升温,
故答案为,30;升高温度;
(3)二氧化氮具有强的氧化性,能够氧化亚硫酸氢根离子生成硫酸根离子,二氧化氮被还原为氮气,离子方程式:2NO2+4HSO3-=N2+4SO42-+4H+;
故答案为:2NO2+4HSO3-═N2+4SO42-+4H+;
(4)从图示知,粗硅变化为SiH4,失电子发生氧化反应,B为电源的正极,A为电源的负极,H-移向阳极生成SiH4,电极反应式为Si+4H--4e-=SiH4↑,
故答案为:负; Si+4H--4e-═SiH4↑.
点评 本题考查硅及其化合物的性质,读懂图象、理顺平衡常数与转化率间的关系、注意电化学电极反应式的书写是解题的关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案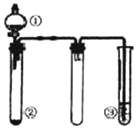 利用如图所示装置进行下列实验,能得出相应实验结论的是( )
利用如图所示装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀盐酸 | CaCO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
| B | 浓硫酸 | 蔗糖 | Ba(NO3)2溶液 | 验证SO2与可溶性钡盐可生成白色沉淀 |
| C | 浓氨水 | 生石灰 | 酚酞溶液 | 氨气的水溶液呈碱性 |
| D | 浓硝酸 | Fe | NaOH溶液 | 铁和浓硝酸反应可生成NO2 |
| A. | A | B. | B | C. | C | D. | D |
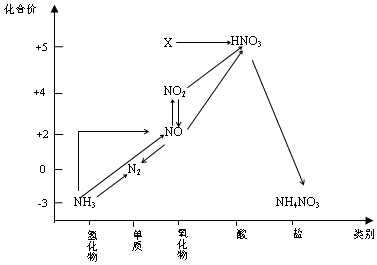
| A. | X是N2O5 | |
| B. | 可用排空气法收集NO气体 | |
| C. | 工业上以NH3、空气、水为原料生产硝酸 | |
| D. | 由NH3→N2,从原理上看,NH3可与NO2反应实现 |
| A. | 地沟油不宜食用,可分馏提取汽油 | |
| B. | 二氧化硅可用于制取光导纤维 | |
| C. | 为防止富脂食品氧化变质,在包装袋中放入生石灰 | |
| D. | 钠、钾、铁等金属有绚丽的颜色,可用于制造焰火 |
| A. | K+、ClO‐、SO42‐、HCO3‐一定能共存于 c(Fe3+)=0.1mol•L‐l 的溶液中 | |
| B. | 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 在NaClO和NaCl混合溶液中滴入过量SO2气体,反应的离子方程式为:SO2+3C1O‐+H2O═SO42‐+C1‐+2HClO | |
| D. | Na+、HCO3-、Br-、Mg2+可以在 pH=8 的溶液中共存 |
| A. | 3.0g | B. | 6.0g | C. | 9.0g | D. | 18.0g |
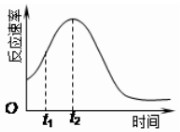 某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种.
某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种.猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:….
(1)猜想Ⅱ可能是:生成的Mn2+在反应中起到催化剂的作用,加快了反应速率
(2)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容.
| 试管A | 试管B | |
| 加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4,少量MnSO4(s)固体(填物质名称) |
| 实验现象(褪色时间) | 褪色时间10min | 褪色时间<10min(选填“<”“>”或“=”) |
| 结论 | 猜想Ⅱ正确 | |
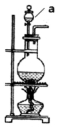 欲设计一个实验验证红热的炭与浓硫酸发生反应所生成的各种产物.某同学设计的实验流程依次为:气体产物、无水硫酸铜、品红溶液1、酸性高锰酸钾、品红溶液2、澄清石灰水.
欲设计一个实验验证红热的炭与浓硫酸发生反应所生成的各种产物.某同学设计的实验流程依次为:气体产物、无水硫酸铜、品红溶液1、酸性高锰酸钾、品红溶液2、澄清石灰水.