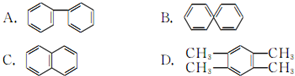题目内容
12.下列对各组物质性质的比较中,正确的是( )| A. | 熔点:Li<Na<K | B. | 熔沸点:Al>Mg | C. | 密度:Na>Mg>Al | D. | 硬度:Mg<K |
分析 A.碱金属元素从上到下,金属的熔点逐渐降低;
B.金属晶体中,金属阳离子半径越小,电荷越大,熔沸点越大;
C.钠、镁、铝的密度逐渐增大;
D.通常金属越活泼,则硬度越小.
解答 解:A.碱金属元素从上到下,金属的熔点逐渐降低,应为K<Na<Li,故A错误;
B.Mg和Al金属晶体,铝离子半径最小,电荷最大,则熔沸点:Mg<Al,故B正确;
C.钠镁铝的密度逐渐增大,即Na<Mg<Al,故C错误;
D.通常金属越活泼,则硬度越小,故硬度Mg>K,故D错误;
故选B.
点评 本题考查金属的熔沸点、密度、硬度的大小比较,明确元素周期律和金属晶体的性质是解本题的关键,注意总结规律,难度不大.

练习册系列答案
相关题目
3.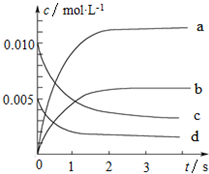 800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)?2NO2,n(NO)随时间的变化如表所示.
800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)?2NO2,n(NO)随时间的变化如表所示.
(1)从0~3s内,用NO表示的平均反应速率v(NO)=2.17×10-3mol•L-1•s-1.
(2)图中表示NO浓度变化的曲线是c(填字母代号).
(3)达平衡时NO的转化率为65%.
(4)能说明该反应已达到平衡状态的是ACD(填序号).
A.混合气体的颜色保持不变
B.混合气体的密度保持不变
C.v逆 (NO2)=2v正 (O2)
D.混合气体的平均相对分子质量保持不变
(5)若升温到850℃,达平衡后n(NO)=n(NO2),则反应向逆反应方向(填“正反应方向”“逆反应方向”)移动.
(6)若在一定条件下0.2molNO气体与氧气反应,达平衡时测得放出的热量为akJ,此时NO转化率为80%,则2molNO气体完全反应放出的热量为12.5akJ.
 800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)?2NO2,n(NO)随时间的变化如表所示.
800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)?2NO2,n(NO)随时间的变化如表所示.| 时间∕s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)∕mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO浓度变化的曲线是c(填字母代号).
(3)达平衡时NO的转化率为65%.
(4)能说明该反应已达到平衡状态的是ACD(填序号).
A.混合气体的颜色保持不变
B.混合气体的密度保持不变
C.v逆 (NO2)=2v正 (O2)
D.混合气体的平均相对分子质量保持不变
(5)若升温到850℃,达平衡后n(NO)=n(NO2),则反应向逆反应方向(填“正反应方向”“逆反应方向”)移动.
(6)若在一定条件下0.2molNO气体与氧气反应,达平衡时测得放出的热量为akJ,此时NO转化率为80%,则2molNO气体完全反应放出的热量为12.5akJ.
20.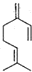 已知1,3-丁二烯结构中,两个碳碳双键中相隔一个单键,像具有这样结构的烯烃称为共轭二烯烃,加成时可以发生1,2加成和1,4加成,β-月桂烯的结构如图所示,一分子该物质与两分子溴发生加成反应的产物(不考虑顺反异构)理论上最多有( )
已知1,3-丁二烯结构中,两个碳碳双键中相隔一个单键,像具有这样结构的烯烃称为共轭二烯烃,加成时可以发生1,2加成和1,4加成,β-月桂烯的结构如图所示,一分子该物质与两分子溴发生加成反应的产物(不考虑顺反异构)理论上最多有( )
 已知1,3-丁二烯结构中,两个碳碳双键中相隔一个单键,像具有这样结构的烯烃称为共轭二烯烃,加成时可以发生1,2加成和1,4加成,β-月桂烯的结构如图所示,一分子该物质与两分子溴发生加成反应的产物(不考虑顺反异构)理论上最多有( )
已知1,3-丁二烯结构中,两个碳碳双键中相隔一个单键,像具有这样结构的烯烃称为共轭二烯烃,加成时可以发生1,2加成和1,4加成,β-月桂烯的结构如图所示,一分子该物质与两分子溴发生加成反应的产物(不考虑顺反异构)理论上最多有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 6种 |
7.日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-=Zn2+,2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O.有关锌-锰干电池的叙述中,正确的是( )
| A. | 锌-锰干电池中锌筒为正极,石墨棒为负极 | |
| B. | 锌-锰干电池即使不用,放置过久,也会失效 | |
| C. | 锌-锰干电池工作时,电流方向是由锌筒经外电路流向石墨棒 | |
| D. | 锌-锰干电池可实现化学能向电能和电能向化学能的相互转化 |
17.下列电子式中错误的是( )
| A. | Na+ | B. |  | C. |  | D. |  |
4.一种气态烷烃和一种气态烯烃组成的混合物共10g,混合气体的密度是相同状况下H2密度的12.5倍.该混合气体通过装有溴水的试剂瓶时,试剂瓶的质量增加了8.4g,该混合气体可能是( )
| A. | 乙烷和乙烯 | B. | 乙烷和乙烯 | C. | 甲烷和乙烯 | D. | 甲烷和丙烯 |
 (Ⅰ)和
(Ⅰ)和 (Ⅱ)
(Ⅱ)